المتابعة الزمنية لتحول كيميائي. الاجابة عن الأسئلة
المتابعة الزمنية لتحول كيميائي. الاجابة عن الأسئلة
ملاحظة: توجد وثيقة التلميذ بصيغة الـ PDF في نهاية المقال
I ـ تذكير:
1 ـ علاقة كمية المادة و الناقلية الكهربائية:
لدينا :
G = σ.S/L → (1)
حيث:
G : الناقلية الكهربائية و تقاس السيمنس (S)
σ : الناقلية الكهربائية النوعية (الناقلية النوعية) وتقاس بالسيمنس
على المتر (S/m)
S : مساحة سطح أحد لبوسي خلية قياس الناقلية ويقاس بالمتر مربع (m2)
L : البعد بين اللبوسين ويقاس بالمتر (m)
ولدينا :
K = S/L → (2)
حيث :
K : ثابت خلية قياس الناقلية ويقاس بالمتر (m)
بتعويض (2) في (1) نجد :
G = K.σ →(3)
ولدينا :
σ = λ.C →(4)
حيث :
λ : الناقلية النوعية المولية الشاردية وتقاس بـ (S.m2/mol)
C : التركيز المولي للمحلول المستخدم و يقاس بالمول على المتر
المكعب (mol/m3)
بتعويض (4) في (3) نجد :
G = K.λ.C →(5)
ولدينا :
C = n/V → (6)
حيث :
n : كمية المادة و تقاس بالمول (mol)
V : حجم المحلول ويقاس بالمتر المكعب (m3)
بتعويض (6) في (5) نجد :
G = K.λ.n/V
وبتعويض (6) في (4) نجد :
σ = λ.n/V
ملاحظة:
يمكن استخدام قانون كولروش
2 ـ تفاعلات الأكسدة و الارجاع:
أ ـ تفاعل الأكسدة :
وهو كل تفاعل كيميائي يتم فيه فقد إلكترون أو أكثر من طرف فرد كيميائي يسمى المرجع (مر)،(Réd) ويمثل تفاعل الأكسدة بمعادلة تسمى المعادلة النصفية الالكترونية للأكسدة كما يلي : Réd → Ox + né
ب ـ تفاعل الإرجاع :
وهو كل تفاعل كيميائي يتم فيه اكتساب إلكترون أو أكثر من طرف فرد كيميائي يسمى المؤكسد (مؤ)،(Ox) ويمثل تفاعل الإرجاع بمعادلة تسمى المعادلة النصفية الالكترونية للإرجاع كما يلي : Ox + né → Réd
II ـ التصنيف الزمني للتحولات الكيميائية:
1 ـ التحول السريع:
نشاط 1:
نسكب تدريجيا محلول من برمنغنات البوتاسيوم (K+(aq) + MnO4-(aq)) على محلول من كبريتات الحديد الثنائي (Fe2+(aq) + SO42-(aq)) المحمض بحمض الكبريت المركز. نلاحظ زوال اللون البنفسجي لبرمنغنات البوتاسيوم مباشرة لحظة مزج المحلولين.
ـ بماذا تفسر زوال اللون البنفسجي ؟ هل هو آني أم تدريجي ؟
نفسر زوال اللون البنفسجي
بحدوث تفاعل كيميائي وهو تحول اني
المعادلة النصفية للإرجاع :
MnO4-(aq) + 8H+(aq)+ 5e- = Mn2+(aq) + 4H2O(l)
5(Fe2+(aq)= Fe3+(aq)+1e-)
معادلة التفاعل المنمذج للتحول الحادث:
أو :
MnO4-(aq) + 5 Fe2+(aq) + 8H3O+(aq)= Mn2+(aq) + 5Fe3+(aq) + 12H2O(l)
ـ عرف التحولات السريعة ؟
هي تفاعلات تصل نهايتها لحظة مزج المتفاعلات أي تستغرق أجزاء من الثانية
فيديو توضيحي حول التحول السريع :
2 ـ التحول البطيء :
نشاط 2 :
نضع حبيبات التوتياء Zn(s) في محلول كبريتات النحاس (Cu2+(aq)
+ SO42-(aq)) (ذي اللون الأزرق العائد لشوارد النحاس)
نلاحظ بعد بضعة دقائق اختفاء اللون الأزرق وتشكل راسب من النحاس.
ـ كيف تفسر زوال اللون الأزرق وتشكل النحاس؟ هل هو آني أم تدريجي؟
ـ أكتب المعادلتين النصفيتين للأكسدة والإرجاع ثم معادلة التفاعل المنمذج للتحول الحادث؟
المعادلة النصفية للإرجاع :
المعادلة النصفية للأكسدة :
Zn(S) = Zn2+(aq) +2e-
معادلة التفاعل المنمذج للتحول الحادث :
نمزج 100mL
من محلول يود البوتاسيوم (K+(aq) + I-(aq))
مع 100mL من محلول بيروكسوديكبريتات البوتاسيوم (2K+(aq) + S2O82-(aq)) بعد الرج :
يظهر عمليا تطور الجملة الكيميائية في تغير لون المزيج
ـ أكتب معادلة التفاعل المنمذج للتحول الكيميائي الحادث ؟
2I-(aq) + S2O82-(aq)
= I2(aq) + 2SO42-(aq)
ـ عرف التحولات البطيئة ؟
التحول الكيميائي البطيء هو تحول يستغرق عدة ثواني أو عدة دقائق
أو عدة ساعات
فيديو توضيحي حول التحول البطيء :
3 ـ التحول البطيء جدا :
نشاط 4 :
نذيب بلورات من برمنغنات البوتاسيوم في الماء المقطر ثم نضع المحلول في قارورة .
* بعد عدة أشهر نلاحظ تشكل راسب أشقر على جدران القارورة ، وهو عبارة عن ثنائي أكسيد المنغنيز MnO2
ـ كيف تفسر تشكل الراسب الأشقر على جدران القارورة ؟
نفسر تشكل الراسب الأشقر على جدران القارورة بحدوث تفاعل كيميائي
ـ أكتب معادلة التفاعل المنمذج للتحول الكيميائي الحادث ؟
المعادلة النصفية للإرجاع
:
المعادلة النصفية للأكسدة :
3(2H2O(aq)= O2(g) + 4H+(aq) + 4e-)
معادلة التفاعل المنمذج للتحول الحادث :
4MnO4-(aq) + 4H+(aq)= 4MnO2(S) + 3O2(g) + 2H2O(l)
التحول الكيميائي البطيء جدا هو تحول يستغرق عدة أيام أو عدة أشهر
أو عدة سنوات ، ونقول حينئذ أن الجملة عاطلة حركيا
III ـ المتابعة الزمنية لتحول كيميائي :
1 ـ متابعة تطور جملة كيميائية عن طريق المعايرة :
نشاط ـ 1 ـ
عند مفاعلة يود البوتاسيوم و بيروكسوديكبريتات البوتاسيوم نلاحظ تشكل ثنائي اليود وفق المعادلة الكيميائية التالية :
2I-(aq) + S2O8
2-(aq) = I2(aq) + 2SO42-(aq)
ـ أنجز جدول التقدم الموضح لتطور التفاعل؟
انجاز جدول التقدم للتفاعل :
|
2I-(aq) + S2O82-(aq) = I2(aq) + 2SO42-(aq) |
معادلة
التفاعل |
||||
|
كميات
المادة (mol) |
التقدم |
حالة
الجملة |
|||
|
0 |
0 |
n0(S2O82-) |
n0(I-) |
0 |
الحالة
الابتدائية |
|
2x |
x |
n0(S2O82-)-x |
n0(I-)
-2x |
x |
الحالة
الانتقالية |
|
2xf |
xf |
n0(S2O82-)-xf |
n0(I-)
-2xf |
xf |
الحالة
النهائية |
I2(aq) + 2S2O32-(aq) = 2I-(aq) + S4O62-(aq)
ـ أنجز جدول التقدم الموضح لتطور تفاعل المعايرة ؟
انجاز جدول التقدم للتفاعل :
|
I2(aq) + 2S2O32-(aq) = 2I-(aq) + S4O62-(aq) |
معادلة
التفاعل |
||||
|
كمـيات
المادة n(mol) |
التقدم |
حالة
الجملة |
|||
|
0 |
0 |
n0(S2O32-) |
n0(I2) |
0 |
الحالة
الابتدائية |
|
x |
2x |
n0(S2O32-)-2x |
n0(I2)
-x |
x |
الحالة
الانتقالية |
|
xe |
2xe |
n0(S2O32-)-2xe |
n0(I2)
-xe |
xe |
الحالة
النــهائية |
من جدول التقدم نجد : n(I2) = x
بالاستعانة بجدول
القياسات التالي :
40 | 35 |
30 | 25 | 20 |
15 | 10 |
5 | 0 | t(min) |
7 | 6,6 |
6,2 | 5,8 | 5,2 |
4,4 | 3,4 | 2 |
0 |
n(I2)10-5mol |
ـ أرسم بيان الدالتين
: x
= f(t)
، C = g(t)
؟
نرسم بيان الدالة (x = f(t
ـ مما سبق هل نستطيع متابعة التقدم في التفاعل بالاعتماد على عملية المعايرة ؟
بما أننا تمكنا من رسم بيان الدالة (x = f(t فإننا نستطيع متابعة التقدم في التفاعل بالاعتماد على عملية المعايرة
2 ـ متابعة تطور جملة كيميائية عن طريق قياس الناقلية :
نشاط ـ 2 ـ
من أجل مــتابعة تطور تفاعل بالاعتماد عــلى جهاز قياس الناقلية الكهربائية . نـقوم بمزج 80 mL من مـــذيب يتــكون من 95% مــن المــــاء و 5% من الايــثانــول مــع حجــما V = 2,0 mL مـن 2 ـ كلورو2 ـ مثيل بروبان و الذي نرمز له اختصارا بالرمز RCl ، تركيزه الكتلي s = 4,0 g/L حيث تحدث له عملية اماهة وفق المعادلة الكيميائية التالية :
RCl(aq) + H2O(l) = ROH(aq) + H+(aq) + Cl-(aq)
ـ أنجز جدول التقدم الموضح لتطور التفاعل؟
أنجاز جدول التقدم الموضح لتطور التفاعل:
|
RCl(aq) + H2O(l) = ROH(aq) + H+(aq) + Cl-(aq) |
معادلة
التفاعل |
|||||
|
كميات
المادة (mol) |
التقدم |
حالة
الجملة |
||||
|
0 |
0 |
0 |
بزيادة |
n0 |
0 |
الحالة
الابتدائية |
|
x |
x |
x |
بزيادة |
n0
- x |
x |
الحالة
الانتقالية |
|
xf |
xf |
xf |
بزيادة |
n0 – xf |
xf |
الحالة
النهائية |
σ = [H+
].λH+ + [Cl-].λCl-
→ (1)
ـ بالاعتماد على جدول التقدم بين أن σ(t) = (λH+ + λ Cl-).x(t)/V ؟
من جدول
التقدم نجد:
[H+] =
x(t)/V و [Cl-] =
x(t)/V
ومنه بالتعويض في (1) نجد:
σ(t) = (x(t)/V).λH+ + (x(t)/V).λCl- → (1)
ومنه : σ(t) = (λH+ + λCl-).x(t)/V
ـ أكتب عبارة σf من أجل xf = n0 ؟من xf = n0
بقسمة (2) على (1) طرف الى طرف نجد:
σf/σ(t) = n0/x(t)
ومنه: x(t) = n0.σ(t)/σf
بالاستعانة بجدول القياسات التالي:
t(s) | 0
|
10 | 20
|
30 | 40
|
50
|
σ(μS/cm)
|
0 | 52,79
|
74,53 | 99,38
|
121,1 | 142,9
|
t(s)
|
60 | 70
|
80 | 90
|
100 | 110
|
σ(μS/cm)
|
161,5
|
171 | 192,5
|
205 | 214,3
| 226,7
|
t(s) | 120 | 140
|
160 | 190 | 220
|
240 |
σ(μS/cm) | 232,9
|
248,4 | 260,9
|
273,3 | 279,5 | 285,7
|
t(s) | 285 | 315
|
365 | 375
|
380 | 450
|
σ(μS/cm) | 291,9
|
295 | 298,1
|
298,1 | 298,1 | 298,1
|
ـ أرسم بيان الدالة σ = k(t) ؟
وبالاعتماد على العلاقة: x(t) = (n0/σf).σ(t)
حيث:
σf = 298,1(µS/cm)
و
n0 = [RCl].V = (S/M).V = (4/92,5).2.10-3 = 8,6.10-5 mol
ومنه: n0/σf =8,6.10-5/298,1= 0,02885 mol.cm.μS-1
بضرب قيم محور σ(μS/cm) في المعامل 0,02885 mol.cm.μS-1
نحصل على بيان الدالة x = f(t)
وبقسمة القيمة 14,4 μmol على V= 82 mL نجد: 0,175 μmol/mL
ومنه نحصل على بيان الدالة (
ـ مما سبق هل نستطيع متابعة التقدم في التفاعل بالاعتماد على قياس الناقلية الكهربائية ؟
بما أننا تمكنا من رسم بيان الدالة x = f(t) فإننا نستطيع متابعة التقدم
في التفاعل بالاعتماد على قياس الناقلية الكهربائية
فيديو توضيحي حول المعايرة الحجمية :
IV ـ زمن نصف التفاعل:
هو المدة الزمنية اللازمة لبلوغ مقدار التقدم (X) لتفاعل كيميائي نصف قيمه النهائية (Xf) ، ونرمز له بالرمزt1/2 ، والهدف منه تحديد التفاعل الأسرع .t1/2 → Xf
/2
يمكن حساب زمن نصف التفاعل t1/2 بيانيا اعتمادا على المنحنى البياني لمقدار التقدم (X) بدلالة الزمن (t) وكما يلي:
V ـ السرعة و السرعة الحجمية التفاعل:
نشاط ـ 3 ـ
لتكن المعادلة
الكيميائية التالية :
2I-(aq) + S2O82-(aq) = I2(aq) + 2SO42-(aq)
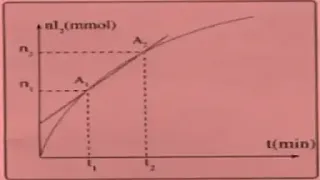
ـ بالاعتماد على البيان n(I2) = f(t) استنتج السرعة المتوسطة والسرعة اللحظية لتشكل I2 ؟
ـ بالاعتماد على البيان [I2] = g(t) استنتج السرعة الحجمية لتشكل I2 ؟
ـ بالاعتماد على البيان n(S2O82-) = f(t) استنتج السرعة المتوسط والسرعة اللحظية لاختفاء
؟ S2O82-
ـ بالاعتماد على البيان
[S2O82-] = g(t)
استنتج السرعة الحجمية لاختفاء
S2O82-
ـ أكتب العبارة العامة لكل من سرعة التفاعل والسرعة الحجمية للتفاعل؟
الاجابة :
استنتاج السرعة
المتوسطة لتشكل I2
:
vmp(I2) =
(n2 – n1)/(t2 – t1) = Δn(I2)/Δt
أي أن السرعة المتوسطة لتشكل I2 تمثل ميل المستقيم الذي يشمل النقطتين A1 ، A2 في بيان الدالة n(I2) = f(t)
استنتاج
السرعة اللحظية لتشكل I2 :
vp(I2)
= dn(I2)/dt
أي أن السرعة اللحظية لتشكل I2 تمثل ميل المماس عند النقطة المقصودة في بيان الدالة n(I2) = f(t)
استنتاج
السرعة الحجمية المتوسطة لتشكل I2 :
v(vol)mp(I2)
= ([I2]2 – [I2]1)/(t2 –
t1) = Δ[I2]/Δt
أي أن السرعة الحجمية المتوسطة لتشكل I2 تمثل ميل المستقيم الذي يشمل النقطتين A1 ، A2 في بيان الدالة
[I2] = g(t)
ولدينا : [I2] = n(I2)/V و منه : v(vol)mp(I2)
= Δn(I2)/V.Δt ومنه : v(vol)mp(I2)
= vmp(I2)/V
استنتاج
السرعة الحجمية اللحظية لتشكل I2 :
v(vol)p(I2)
= d[I2]/dt
أي أن السرعة الحجمية اللحظية لتشكل I2 تمثل ميل المماس عند النقطة
المقصودة في بيان الدالة [I2] = g(t)
ولدينا : [I2] = n(I2)/V و منه : v(vol)p(I2) = dn(I2)/V.dt ومنه : v(vol)p(I2) = vp(I2)/V
استنتاج
السرعة المتوسطة لاختفاء S2O82- :
vmR(S2O82-) = - (n2 –
n1)/(t2 – t1) = - Δn(S2O82-)/Δt
استنتاج
السرعة اللحظية لاختفاء S2O82-
:
vR(S2O82-) = - dn(S2O82-)/dt
أي أن السرعة اللحظية لاختفاء S2O82- تمثل القيمة المطلقة لميل المماس عند النقطة المقصودة في بيان الدالة
n(S2O82-) = f(t)
استنتاج السرعة الحجمية المتوسطة لاختفاء S2O82- :
v(vol)mR(S2O82-) = - ([
S2O82-]2 – [S2O82-]1)/(t2
– t1) = - Δ[S2O82-]/Δt
ولدينا :
[S2O82-] = n(S2O82-)/V
و منه :
v(vol)mR(S2O82-) = - Δn(S2O82-)/V.Δt
ومنه :
v(vol)mR(S2O82-) = vmR(S2O82-)/V
استنتاج السرعة الحجمية اللحظية لاختفاء S2O82- :
v(vol)R(S2O82-) = - d[S2O82-]/dt
أي أن السرعة الحجمية اللحظية لاختفاء S2O82- تمثل القيمة المطلقة لميل المماس عند النقطة المقصودة في بيان الدالة
[S2O82-] = g(t)
ولدينا :
[S2O82-] = n(S2O82-)/V
و منه :
v(vol)R(
S2O82-) = - dn(
S2O82-)/V.dt
ومنه :
v(vol)R(S2O82-) = vR(S2O82-)/V
VI ـ العوامل الحركية و أهميتها :
رأينا في النشاطات الخاصة بالتحولات البطيئة والبطيئة جدا التي تحدث في جملة كيميائية أن التحول الكيميائي في هذه الجمل يأخذ وقتا طويلا نوعا ما ولهذا فإننا في حاجة لتسريع هذه التحولات لكي نحصل على تطور في تراكيز أفراد الجملة المتحولة في وقت قصير نوعا ما . إن العوامل التي تؤثر على مدة تحول جملة كيميائية تدعى: العوامل الحركية
1 ـ التراكيز الابتدائية :
نشاط :
ـ نضع في كاس بيشر رقم (1) 50mL من محلول مائي لحمض الأكساليك H2C2O4(aq) تركيزه المولي
C1 = 1.10-2 mol.L-1 ودرجة حرارته θ = 25ºC.
ـ نضع في كاس بيشر رقم (2)
من محلول مائي لحمض الأكساليك H2C2O
4(aq) تركيزه المولي
C2 = 1
mol.L-1 ودرجة حرارته θ = 25ºC.
ـ نضيف للكاسين حوالي 50mL من محلول مائي لفوق منغنات البوتاسيوم
(K+
(aq) + MnO4-(aq)) المحمض
يمثل الشكل ـ أ ـ الكاسين (1) و(2) لحظة مزج المحلولين ، بينما الشكل ـ ب ـ يمثل الكاسين بعد 5 دقائق من لحظة مزج المحلولين.
1/ أي الكأسين حدث فيها التحول بشكل أسرع ؟
يحدث التحول بشكل أسرع في الكأس الثانية
2/ ماذا تستنتج في ما يخص تأثير عامل التركيز على سرعة التحول الكيميائي؟
نستنتج أن زيادة التركيز تؤدي الى زيادة سرعة التفاعل
2 ـ درجة الحرارة :
نشاط :
ـ نضع في كأس بيشر رقم (1) 50mL من محلول مائي لحمض الأكساليك H2C2O4(aq) تركيزه المولي
ـ نضع في كأس بيشر رقم (2) 50mL من محلول مائي لحمض الأكساليك H2C2O
4(aq) تركيزه المولي
C = 1.10-2 mol.L-1 ودرجة حرارته
θ = 45ºC .
ـ نضيف للكأسين حوالي 50mL من محلول مائي لفوق منغنات البوتاسيوم
(K+(aq) + MnO4-(aq)) المحمض
يمثل الشكل ـ أ ـ الكأسين (1) و(2) لحظة مزج المحلولين ، بينما الشكل ـ ب ـ يمثل الكأسين بعد 5 دقائق من لحظة مزج المحلولين .
1/ أي الكأسين حدث فيها التحول بشكل أسرع ؟
يحدث التحول بشكل أسرع في الكأس الثانية
2/ ماذا تستنتج في ما يخص تأثير عامل درجة الحرارة على سرعة التحول الكيميائي ؟
نستنتج أن زيادة درجة الحرارة تؤدي الى زيادة سرعة التفاعل
فيديو توضيحي حول تأثير درجة الحرارة :
3 ـ الوساطة:
الوسيط هو عبارة عن نوع كيميائي يوضع عند اللحظة t = 0 مع الجملة الكيميائية المدروسة بحيث يساعد على تسريع التفاعل . حيث توجد ثلاثة أنواع من الوساطة :
أ ـ الوساطة المتجانسة:
يكون فيها الوسيط في نفس الحالة المادية التي تكون فيها الأفراد المتفاعلة في الجملة الكيميائية . أي يكون للوسيط والمتفاعلات نفس الطور
ب ـ الوساطة الغير متجانسة:
تكون الحالة المادية للوسيط تختلف عن الحالة المادية للأفراد المتفاعلة .
فيديو توضيحي حول الوساطة الغير متجانسة :
جـ ـ الوساطة الإنزيمية:
يكون الوسيط من طبيعة حيوية كالإنزيمات .
فيديو توضيحي حول الوساطة الانزيمية :
4 ـ التفسير المجهري:
أ ـ الحركة البروونية:
وهي الحركة العشوائية للأفراد المجهرية المكونة لمائع (سائل أو غاز) ، وتزداد سرعتها عند تسخينها ، وبالتالي تزداد طاقتها الحركية المجهرية ، وتتعلق الحركة البروونية بدرجة الحرارة ويطلق عليها أحيانا بالحركة الحرارية .












تعليقات
إرسال تعليق