تعيين كمية المادة بواسطة المعايرة. الاجابة عن الأسئلة
تعيين كمية المادة بواسطة المعايرة. الاجابة عن الأسئلة
ملاحظة: توجد وثيقة التلميذ بصيغة الـ PDF في نهاية المقال.
1 ـ التفاعل بين المحاليل الحمضية والأساسية:
1 ـ 1 ـ تعريف الحمض والأساس حسب برونشتد ـ لوري:
أ ـ تعريف الحمض:
هو كل مركب كيميائي، جزيئيا كان أم شارديا، قادر على منح (تحرير) بروتونH+، أو أكثر لمركب آخر خلال تفاعل كيميائي.
أمثلة:
HCl(g) + H2O(l)
→ H3O+(aq) + Cl-(aq)
H2SO4(aq) +
2H2O(l) → 2H3O+(aq) + SO42-(aq)
CH3COOH(aq)
+ H2O(l) = H3O+(aq) + CH3COO-(aq)
ب ـ تعريف الأساس:
أمثلة:
NH3(g) + H2O(l) = NH4+(aq) + OH-(aq)
وبوجود الماء يحدث التفاعل التالي:
NaOH(s) → Na+(aq)
+ OH-(aq)
1 ـ 2 ـ مفهوم الثنائية) أساس/حمض):
- عندما يفقد الحمض شارة H+، فإنه يعطي أساسا نسميه أساس مرافق.
- عندما يكتسب الأساس شاردة H+، فإنه يعطي حمضا نسميه حمض مرافق.
1 ـ 3 ـ أمثلة لبعض الثنائيات )حالة خاصة لثنائيتي الماء(:
|
معادلة
التفكك |
الثنائية (اساس/حمض) |
اسم
المركب |
|
CH3COOH(aq)=H+(aq) + CH3COO-(aq) | CH3COOH/CH3COO- |
حمض الايثانويك |
|
NH4+
= NH3 + H+ |
NH4+/NH3 |
شاردة الأمونيوم |
|
H3O+
= H2O + H+ |
H3O+/H2O |
شاردة الهيدرونيوم |
|
H2O = H+ + OH- |
H2O/OH- |
المــاء |
|
HCO3-
= CO32- + H+ |
HCO3-/CO3-2 |
شاردة كربونات الهيدروجين |
1 ـ 4 ـ المحاليل الحمضية والمحاليل الأساسية:
1 ـ 4 ـ 1 ـ تصنيف المحاليل الكيميائية إلى حمضية وأساسية بواسطة كاشف أزرق البروموثيمول (BBT)
ـ ماذا تلاحظ بعد إضافة الكاشف إلى المحاليل؟
يتغير لون
المحاليل.
ـ رتب المحاليل حسب تماثل ألوانها بوجود
الكاشف؟
|
لون أصفر |
لون أزرق |
|
H2SO4 |
NaOH |
|
HCl |
KOH |
|
عصير الليمون |
|
|
الأحماض |
الأسس |
|
H2SO4 |
NaOH |
|
HCl |
KOH |
|
عصير الليمون |
|
الاستنتاج:
1 ـ 4 ـ 2 ـ المعايرة اللونية حمض ـ أساس:
ـ تحقيق معايرة حمض كلور الماء بواسطة محلول الصود باستعمال كاشف ملون:
التجربة:
ضع Va = 20 mL من محلول HCl في بيشر سعته 100 mL، مع مخلاط مغناطيسي، وأضف قطرتين من محلول BBT، قم بتحضير محلول NaOH تركيزه معلوم Cb = 10-2 mol.L-1
ـ املأ السحاحة بالمحلول المحضر من .NaOH
ـ أضبط سطح المحلول داخل السحاحة على إشارة
الصفر.
ـ شغل المخلاط المغناطيسي، ثم ابدأ في
إضافة قطرات من محلول NaOH بواسطة السحاحة.
ـ ماهي الأدوات الزجاجية اللازمة لأخذ 20 mL من محلول HCl ؟
ماصة
سعتها 20mL، انبوب
مدرج، بيشر مدرج.
ـ ما هو لون المحلول في البيشر عند إضافة
كاشف BBT ؟ (قبل إضافة المحلول
الأساسي من السحاحة).
لون المحلول في
البيشر عند إضافة كاشف BBT أصفر.
ـ عند إضافة الأساس على الحمض، فإنه يحدث
تفاعل يسمى تفاعل حمض – أساس بواسطة الثنائية (أساس/حمض)، وهو سريع وتام.
ـ ما هما الثنائيتان
(أساس/حمض) الداخلتان في التفاعل؟
الثنائيتين هما: (H2O/OH-)، (H3O+/H2O).
ـ أكتب معادلة
التفاعل الكيميائي الحادث بينهما ؟
(H+(aq)+Cl-(aq)) + (Na+(aq)+OH-(aq)) = (Na+(aq)+Cl-(aq)) +H2O(ℓ)
أ - بداية المعايرة:
في
بداية المعايرة نبدأ بإضافة قطرات من
محلول NaOHالموجود في السحاحة. على محلول HClالموجود في البيشر.
ـ هل يحدث تغير في لون المحلول ؟ علل
إجابتك ؟
يختفي
اللون الأصفر تدريجيا بسب تفاعل HIn وHO-
ـ ما هو المتفاعل المحد للتفاعل حمض– أساس
الحادث في بداية المعايرة ؟
في البداية يكون الأساس (HO-) هو المتفاعل المحد.
ـ حدد المتفاعل الموجود بزيادة وأملأ جدول
تقدم التفاعل من أجل حجم مضاف من الأساس قدره Vb
؟
المتفاعل الموجود بزيادة هو الحمض (H3O+).
|
(H+(aq)+Cl-(aq)) + (Na+(aq)+OH-(aq))
= H2O(l) + (Na+(aq)+Cl-(aq)) |
معادلة
التفاعل |
||||
|
كميات
المادة n(mol) |
التقدم |
حالة
الجملة |
|||
|
0 |
0 |
nb=CbVb |
na=CaVa |
0 |
الحالة
الابتدائية |
|
x |
x |
CbVb-x |
CaVa-x |
x |
الحالة
الانتقالية |
|
xmax |
xmax |
0 |
CaVa-xmax |
xmax=
CbVb |
الحالة
النهائية |
حيث:
Ca: تركيز محلول الحمض.
Cb: تركيز محلول الأساس.
Vb:
حجم المحلول الأساسي المضاف من السحاحة إلى البيشر.
ب - نقطة التكافؤ:
أكمل إضافة قطرات من محلول NaOH، حتى تلاحظ
تغير في اللون ولا يزول بالتحريك ، عندها توقف عن الإضافة.
ـ ما هو اللون الجديد للمحلول في البيشر؟
اشرح لماذا تحدث هذه الظاهرة ؟
عند هذه النقطة يستهلك كل المتفاعل المعايَر والمتفاعل المعايِر، لذا يأخذ المحلول اللون الأخضر، لأن:
[HIn] = [In-]
ـ عبر عن التقدم x باستخدام جدول تقدم التفاعل السابق، وذلك بدلالة Va
وCa، ثم بدلالة VbE
وCb، إذا علمت أنه في هذه الحالة المتفاعلات
تفاعلت كلية ؟
لدينا: CaVa
– xe = 0 ومنه:
xe
= CaVa
ولدينا: CbVb
– xe = 0 ومنه:
xe
= CbVb
ـ ارمز لـ Vb بالرمز Vbe ، وأوجد العلاقة بين Cb، Vbe، Va، Ca
لدينا: n0(H3O+) = ne(HO-) ومنه: CaVa
= CbVbe
ـ أحسب التركيز Ca لمحلول HCl ؟
ـ أحسب النسبة بين كمية مادة المتفاعلين عند نقطة التكافؤ، وقارنها مع النسبة بين الأعداد الستوكيوميترية ؟
جـ - بعد التكافؤ:
استمر في إضافة الأساس.
ـ هل يتغير اللون ؟ علل إجابتك؟
يتحول اللون إلى الأزرق وذلك لإستهلاك كل شوارد (H3O+)، وزيادة شوارد (HO-).
- ما هو المتفاعل المحد الآن ؟
هو حمض كلور الماء.
الاستنتاج:
محلول
HCl يتلون بالأصفر مع BBT، وعند إضافة حجوم من الأساس له، يتفاعل الحمض والأساس، فتنقص شدة
اللون الأصفر الذي يتحول تدريجيا إلى الأخضر، وعند نقطة التكافؤ، التي تتميز بأن كمية
المواد المتفاعلة تكون بنسب الأعداد الستوكيوميترية لمعادلة التفاعل الحادث. في هذه
النقطة تكون المتفاعلات قد تفاعلت كلية.
قبل
نقطة التكافؤ كان المتفاعل المحد هو هيدروكسيد
الصوديوم، وبعد نقطة التكافؤ أصبح المتفاعل المحد هو حمض كلور الماء، إذن نقطة التكافؤ هي النقطة التي
يتغير فيها المتفاعل المحد.
1 ـ 4 ـ 3 ـ المعايرة عن طريق قياس الناقلية:
تجربة:
- خذ 2mL من
المحلول التجاري لهيدروكسيد الصوديوم بواسطة ماصة، وأضف إليها ماء مقطر حتى يصبح
الحجم 500mL، وأفرغها
في بيشر.
- أضف إلى المحلول قطرتين من أزرق البروموتيمولBBT
ـ املأ السحاحة بمحلول (H3O++ Cl-) تركيزه المولي 0,1mol/L .
أدخل خلية القياس في البيشر الذي يحتوي محلول NaOH (100 mL) ، وقس الناقلية الكهربائي عند كل إضافة من المحلول الحمضي، سجل اللون الذي يأخذه المزيج عند كل إضافة.
|
20 |
16 |
12 |
8 |
4 |
0 |
V(mL) |
|
|
|
|
|
|
|
G(mS) |
|
|
|
|
|
|
|
لون المزيج |
|
35 |
27 |
25 |
24 |
23 |
22 |
V(mL) |
|
|
|
|
|
|
|
G(mS) |
|
|
|
|
|
|
|
لون المزيج |
- أكتب معادلة التفاعل الحادث بعد مزج المحلولين. ما هو نوع هذا التفاعل؟
2- أملأ الجدول، ثم أرسم G = f(V) ، واشرح
البيان؟
3- اشرح تغيرات لون الكاشف BBT ؟
4- أنشئ ملخص جدول تقدم التفاعل من أجل V < Veq، Veq: الحجم
عند نقطة التكافؤ، ثم من أجل V > Veq ؟
5- كيف نميز نقطة التكافؤ في البيان G = f(V) ؟
6- عين نقطة التكافؤ، ثم أحسب [OH-] في المحلول المعاير، ثم [OH-] في
المحلول التجاري (المنظف) ؟
الحـــل:
1- معادلة
التفاعل الحادث هي:
H3O+(aq)
+ OH-(aq) = 2H2O(l)
نوع التفاعل: هو تفاعل حمض – أساس.
2- اتمام الجدول:
|
20 |
16 |
12 |
8 |
4 |
0 |
V(mL) |
|
6,0 |
7,5 |
9,1 |
10,8 |
12,5 |
14,2 |
G(mS) |
|
أزرق |
أزرق |
أزرق |
أزرق |
أزرق |
أزرق |
لون المزيج |
|
35 |
27 |
25 |
24 |
23 |
22 |
V(mL) |
|
16 |
9,7 |
8,1 |
7,3 |
6,6 |
6,1 |
G(mS) |
|
أصفر |
أصفر |
أصفر |
أصفر |
أصفر |
أصفر |
لون المزيج |
- البيان G = f(V)
شرح البيان: نميز في البيان ثلاثة مراحل:
أ-
قبل التكافؤ:
عند إضافة الحمض، تتفاعل شوارد الهيدرونيوم مع
شوارد الهيدروكسيد لتعطي الماء، فيتناقص تركيز شوارد الهيدروكسيد، وتبقى شوارد
الهيدروكسيد في البيشر بعد تفاعل حمض– أساس، ولذلك المحلول الناتج أساسي، فيكون
لون الكاشف أزرق في المحلول.
ب - عند نقطة التكافؤ:
تكون عندها كل شوارد OH– قد تفاعلت مع الشوارد H3O+ ، وينتج الماء لذلك الناقلية
تكون لها أدنى قيمة لأن عدد الشوارد أقل ما يمكن. تعني نقط التكافؤ نقطة تقاطع
المستقيمين الناتجين من البيان G = f(V) قبل التكافؤ وبعد التكافؤ. كما في البيان.
جـ - بعد نقطة التكافؤ:
نضيف محلول الحمض فتضاف شوارد H3O+ في الكأس، وتبقى في المحلول إلا
أنها لا تتفاعل مع OH- التي تفاعلت كلية
عند نقط التكافؤ. فتزداد الناقلية للمحلول بسرعة لأن شوارد H3O+ ذات
ناقلية نوعية مولية عالية، وعليه يكون المحلول في الكأس حمضي، ولذلك فإن لون
الكاشف أصفر.
3 – شرح تغير اللون:
- قبل التكافؤ: لون المحلول
أزرق لأن المحلول أساسي.
- عند نقطة التكافؤ: لون المحلول أخضر لأن المحلول معتدل.
- بعد نقطة التكافؤ: لون المحلول أصفر لأن المحلول حمضي.
4 - ملخص جدول تقدم التفاعل:
|
|
عدد مولات الحمض المضاف |
عدد مولات المحلول الأساسي التجاري |
|
المرحلة الابتدائية |
0 |
0,1 × C |
|
قبل التكافؤ |
0,1 ×
V |
0,1 × C -
0,1V |
|
نقطة التكافؤ |
0,1Veq=
0,1×21,5×10-3mol |
0,1 × C -
0,1 . Veq= 0 |
|
بعد نقطة التكافؤ |
0,1( V -
0,0215 ) mol |
0 |
5 - عند نقطة التكافؤ تكون كمية مادة الحمض، وكمية مادة الأساس في المنظف في تناسب مع الأعداد الستوكيوميترية. وهي بيانيا النهاية الحدية الصغرى للدالة: G = f(V)، أوهي النقطة التي يأخذ عندها المحلول اللون الأخضر.
0,1.C
= 0,1Veq = 2,15×10-2 mol
حيث نقرأ من البيان Veq = 21,5 ml
ومنه: C = 2,15×10-2 mol.L-1
6- حساب تركيز المحلول المنظف:
بما أننا عايرنا محلول مخفف من المنظف ووجدنا تركيزه المولي
C1 = 2,15×10-2mol/L
باستخدام قانون التخفيف:
C1V1 = C2V2
نجد:
ومنه:
2 ـ تفاعل الأكسدة ـ
الإرجاعية:
2 ـ 1 ـ مفهوما المؤكسد والمرجع:
نشاط ـ 1 ـ
التعرف على مفهوم المؤكسد والمرجع
التجربة:
ضع كمية من محلول AgNO3
في كأس، وضع فيه قطعة نحاس. انتظر10 دقائق، وأرسم التجهيز التجريبي
(الكأس والمحلول وقطعة النحاس)، مستعملا الألوان المناسبة في التجربة، مبينا
التغيرات التي حدثت في المحلول، وقطعة النحاس.
ـ سجل ملاحظاتك حول: المحلول وقطعة النحاس؟
نلاحظ ظهور لون جديد في المحلول وهو لون أزرق، وكذلك ظهور اللون الفضي على قطعة النحاس.
ـ هل حدث تحول كيميائي؟ برر إجابتك؟
إن ظهور اللون الأزرق في
المحلول، واللون الفضي على قطعة النحاس هو
دليل على حدوث تفاعل كيميائي وفق المعادلة الكيميائية التالية:
2Ag+(aq) + Cu(s) → Cu2+(aq)+
2Ag(s)
ـ ما هو اللون الجديد
الظاهر في المحلول ؟
اللون الجديد الظاهر في المحلول هو اللون الأزرق، وهو راجع لوجود شوارد النحاس Cu2+ في المحلول.
ـ ما هي الشاردة التي
لونت المحلول ؟
هي شاردة النحاسCu2+
ـ أكتب معادلة تفاعل تنمذج التحول الكيميائي الذي حدث لذرة النحاس، وحولها إلىCu2+ ؟
Cu(S) → Cu2+(aq) + 2e-
ـ هل ظهر جسم جديد ؟ ما لونه ؟ برر إجابتك ؟
نتج عن
هذا التفاعل جسم جديد هو الفضة Ag، التي ترسبت على قطعة النحاس بلون فضي.
ـ أكتب معادلة تفاعل كيميائي تنمذج تحول شاردة الفضة Ag+ إلى Ag ؟
Ag+(aq) + e- → Ag(S)
الاستنتاج:
عند إدخال قطعة النحاس في محلول نترات الفضة (Ag++NO-3) ذي اللون الشفاف، وبعد 10 دقائق نلاحظ ظهور اللون الأزرق
في المحلول، الذي يدل على وجود شوارد Cu2+ فيه، فنستنتج أن ذرة النحاس تحولت
إلى شاردة النحاس بفقدها إلكترونين، كما نلاحظ ترسب معدن أبيض هو معدن الفضة، فنستنتج أن
الشاردة Ag+ تحولت إلى ذرة الفضة، وترسبت على
قطعة النحاس التي تآكلت.
قـاعــدة:
- نقول عن الجسم الذي فقد إلكترون أو أكثر أنه تَأَكْسَدَ، ونسميه مُرْجٍـعْ.
- نقول عن الجسم الذي اكتسب إلكترون أو أكثر أنه أٌرْجٍعَ، ونسميه مُؤَكْسِدْ.
نشاط ـ 2 ـ
تحديد المؤكسد والمرجع خلال تحول كيميائي.
التجربة:
ضع في كأس محلول CuSO4 ، ثم أضف إليه كمية من قطع معدن الزنك
Zn .انتظر10
دقائق.
ـ ماذا تلاحظ ؟
نلاحظ زوال اللون الأزرق، وتشكل راسب أحمر.
ـ أكمل الرسم مستعملا الألوان المناسبة عند انتهاء التفاعل.
ـ هل حدث تحول كيميائي؟ برر إجابتك ؟
نعم، لأن إختفاء اللون الأزرق، وظهور اللون الأحمر يدل
على حدوث تحول كيميائي.
ـ ما هو اللون المختفي؟
اشرح سبب هذه الظاهرة ؟
اللون المختفي هو اللون الأزرق، وسببه هو اختفاء شوارد
النحاس.
ـ ما هو الجسم الجديد
الظاهر؟
يظهر جسم جديد هو النحاس Cu.
ـ أكتب معادلة تنمذج
التحول الذي حدث لشاردة النحاس الثنائي، حيث تحولت إلى Cu ؟
Cu2+(aq)
+ 2e- → Cu(s)
ـ أكتب معادلة تنمذج
التحول الكيميائي الحادث للزنك Zn ، حيث تحول إلى شاردة الزنك ؟
Zn(S) → Zn2+(aq)
+ 2e-
تعاريف:
الأكسدة:
هي عبارة عن تغير كيميائي يصاحبه فقدان الإلكترونات من ذرة، أو من مجموعة من
الذرات.
ـ ونقول عن الجسم الذي فقد إلكترون أو أكثر، أنه تَأَكْسَدَ، ونسميه مُرْجِعْ.
الارجاع:
هو عبارة عن تغير كيميائي يصاحبه اكتساب
للإلكترونات من طرف ذرة، أو مجموعات من الذرات.
- ونقول عن الجسم الذي اكتسب إلكترون أو أكثر، أنه أُرْجِعَ، ونسميه مُؤَكْسِدْ.
فالمؤكسد هو الفرد الكيميائي (ذرة ـ شاردة ـ جزيء)، الذي يمكن أن يكتسب إلكترون أو أكثر.
مثل:
MnO4-(aq) + 8H+(aq)
+ 5e- = Mn2+(aq) + 4H2O(l)
ox + ne- → réd
فالمرجع هو الفرد الكيميائي (ذرة – شاردة – جزيء)، الذي يمكن أن يعطي إلكترون أو أكثر.
مثال:
Zn(S) = Zn2+(aq) +
2e-
réd → ox + ne-
2 ـ 2 ـ مفهوم الثنائية مر/مؤ:
عندما يحدث تفاعل أكسدة يتم فيه فقد ne- ، حيث n عدد الإلكترونات المفقودة من طرف فرد كيميائي A فيتحول إلى فرد كيمائي آخرAn+ ، وفق المعادلة النصفية التالية:
A → An+ + ne-
يستطيع الفردAn+ بتفاعل عكسي، وهو الإرجاع
في شروط مناسبة. أن يكتسب نفس العدد من الإلكترونات ne ليصبح A ، وفق المعادلة: An+ + ne- → A
نسمي الجملة المتشكلة من الفرد الكيميائي في شكله المرجع A ، وشكله المؤكسد An+ الثنائية (مرجع/مؤكسد) أو (ox/red)، ونكتب: (An+/A)، للمعادلة النصفية:
A = An+ +
ne-
2 ـ 3 ـ أمثلة لبعض الثنائيات (حالة خاصة للمعادن):
أكمل الجدول التالي:
|
المعادلة النصفية |
المرجع |
المؤكسد |
الثنائية (Ox/réd)
|
|
2H++2e- = H2 |
H2 |
H+ |
H+/H2 |
|
MnO4-(aq) + 8H+(aq)
+ 5e- = Mn2+(aq) + 4H2O(l) |
Mn2+ |
MnO4- |
MnO4-/Mn2+ |
|
Fe3++e- = Fe2+ |
Fe2+ |
Fe3+ |
Fe3+/Fe2+ |
|
I2+2e- = 2I- |
I- |
I2 |
I2/I- |
|
S4O62-+2e- = 2S2O32- |
S2O32- |
S4O62- |
S4O62-/S2O32- |
2 ـ 4 ـ المعايرة اللونية:
معايرة محلول ثنائي اليود (I2) بواسطة محلول ثيوكبريتات الصوديوم Na2S2O3
التجربة:
ـ ضع Vo = 10 mL
من محلول ثنائي اليودI2 تركيزه مجهول في بيشر حجمه
100 mL
ـ املأ السحاحة المدرجة بمحلول Na2S2O3 تركيزه Cr = 0,01 mol/L
ـ ضع أسفل السحاحة البيشر، الذي يحتوي على محلول ثنائي اليود I2 ، وابدأ بإضافة قطرات من محلول Na2S2O3 من السحاحة.
ـ ما هي الزجاجيات المستخدمة في أخذ Vo =10 mL من محلول ثنائي اليود ؟
ماصة
سعتها 10 mL
ـ ما هو لون محلول ثنائي اليود ؟
لون محلول ثنائي اليود بني.
ـ ما هو لون محلول ثيوكبريتات الصوديوم ؟
محلول ثيوكبريتات الصوديوم (Na2S2O3)عديم اللون (شفاف).
إن هذا التفاعل تام وسريع، حيث الثنائيتين (مر/مؤ)، ox/red الداخلة في التفاعل هي: S4O62-/S2O32- ، I2/I-
ـ أكتب المعادلة النصف الإلكترونية للأكسدة، والمعادلة النصف الإلكترونية
للإرجاع، ومنه الإجمالية ؟
المعادلة النصفية للأكسدة:
2S2O32- = S4O62- + 2é
المعادلة النصفية للإرجاع:
I2
+2é = 2I-
معادلة الأكسدة الإرجاعية:
2S2O32- = 2I- + S4O62-
I2 +
ـ حدد المؤكسد والمرجع في هذا التفاعل مع التعليل؟
المؤكسد: هو I2 لأنه اكتسب إلكترونات.
المرجع: هو S2O32- لأنه فقد إلكترونات.
أ- بداية المعايرة:
ـ أضف قطرات من محلول Na2S2O3 من السحاحة إلى محلول I2 في البيشر.
لاحظ
أن المتفاعل المحد هو شاردة الثيوكبريتات S2O32- (المتفاعل المعايٍر)، والمتفاعل الموجود بزيادة هو ثنائي اليود I2 (المتفاعل المعايَر).
نعتبر Vo: الحجم الابتدائي لمحلول اليود I2 و Co: تركيز محلول ثنائي
اليود.
Vr: حجم المحلول الذي يحتوي الشوارد S2O32- المضاف من السحاحة.
Cr: تركيز محلول شوارد S2O32-
ـ املأ جدول تقدم التفاعل.
|
I2(aq) + 2S2O32-(aq) =
2I-(aq) + S4O62-(aq) |
معـادلة
التفاعل |
||||
|
كمـيات
المادة n(mol) |
التقدم |
حالة
الجملة | |||
|
0 |
0 |
nr=CrVr |
no=CoVo |
0 |
الحالة
الابتدائية |
|
x |
2x |
CrVr-2x |
Co Vo – x |
x |
الحالة
الانتقالية |
|
xmax |
2xmax |
CrVr-2xmax |
Co Vo – xmax |
xmax = CrVr/2 |
الحالة
النهائية |
ب - نقطة التكافؤ:
عند نقطة التكافؤ، المتفاعلات تكون كمية مادتها في الجملة الكيميائية بالنسب الستوكيوميترية في معادلة تفاعل المعايرة الحادث. ومنه الأفراد المتفاعلة تكون قد تفاعلت كلية ونقوم بإضافة محلول ثيوكبريتات من السحاحة على بيشر، الذي يحتوي محلول اليود .
ـ نوقف إضافة محلول ثيوكبريتات الصوديوم من السحاحة، عندما نلاحظ ظهور لون
جديد ثابت.
ـ ما هو اللون الجديد الظاهر في هذه التجربة ؟
لون المحلول الجديد أصفر.
ـ ظهور اللون الجديد على ماذا يدل؟
ظهور اللون الجديد يدل على وجود نواتج جديدة.
ـ ما هي هذه الحالة المميزة للتفاعل؟
الحالة
المميزة للتفاعل هي التغير اللوني عند نقطة التكافؤ.
الاستنتاج:
لون محلول
ثيوكبريتات الصوديوم في السحاحة شفاف، ولون
محلول اليود في البيشر بني، وبعد إضافة محلول
ثيوكبريتات الصوديوم إلى اليود يبدأ اللون البني يتلاشى، وبعد إضافة حجم مناسب يظهر
لون أصفر في الخليط الموجود في البيشر، ولا
يزول بالتحريك، نقول في هذه الحالة أننا بلغنا نقطة التكافؤ، وتكون كمية المادة للمتفاعلات، موجودة بنسب الأعداد الستوكيوميترية.
ـ املأ الجدول الذي يصف الجملة الكيميائية في نقطة التكافؤ؟
|
I2(aq) + 2S2O32-(aq) =
2I-(aq) + S4O62-(aq) |
معـادلة
التفاعل |
||||
|
كمـيات
المادة n(mol) |
التقدم |
حالة
الجملة |
|||
|
0 |
0 |
nr=CrVr |
no=CoVo |
0 |
الحالة
الابتدائية |
|
x |
2x |
CrVr-2x |
Co Vo – x |
x |
الحالة
الانتقالية |
|
xe |
2xe |
0 |
0 |
xe = CrVre/2 |
الحالة
النهائية |
ـ ما هو عدد مولات اليود I2 عند نقطة التكافؤ؟
عدد مولات اليود I2 عند نقطة التكافؤ هو صفر.
ـ استنتج xe التقدم عند نقطة التكافؤ بدلالة Vo ، Co ؟
عند نقطة التكافؤ: CoVo – xe
= 0 ومنه: xe = CoVo
ـ ما هو عدد مولات شوارد ثيوكبريتات S2O32- عند نقطة التكافؤ؟
عدد مولات شوارد ثيوكبريتات S2O32- عند نقطة
التكافؤ هو صفر.
ـ استنتج xe التقدم بدلالة Vre ، Cr ؟
عند نقطة التكافؤ CrVre – 2xe = 0
ومنه:
ـ استنتج العلاقة:
عند نقطة التكافؤ، ثم أحسبCo تركيز محلول اليود ؟
لدينا: xe = CoVo
ولدينا:
ومنه:
ومنه:
ـ بعد نقطة التكافؤ إذا
أضفنا حجما Vr من محلول ثيوكبريتات الصوديوم، ما هو المتفاعل المحد الآن؟
بعد نقطة التكافؤ المتفاعل المحد هو I2(aq)
الاستنتاج:
قبل نقطة التكافؤ المتفاعل المحد هو ثيوكبريتات الصوديوم، أي المتفاعل المعايٍر، وبعد نقطة التكافؤ، المتفاعل المحد هو محلول اليود أي المتفاعل المعايَر.
تعميـم:
إذا حدث تفاعل تام
بين متفاعلين B ، A حيث معادلة التفاعل هي:
aA + bB → cC + dD
a ، b ، c ، d هي المعاملات
الستوكيوميترية لمعادلة التفاعل.
يكون عند نقطة التكافؤ:
(na عدد مولات A وnb عدد مولات B)، وبما أن n = CV إذن نكتب:
2 ـ 5 ـ المعايرة عن طريق الناقلية:
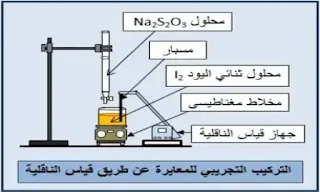
معايرة محلول اليود I2(aq) بمحلول Na2S2O3 عن طريق قياس الناقلية.
التجربة:
خذ حجما Vo = 10 mL من محلول ثنائي اليود I2(aq) تركيزه مجهول، ضعه في بيشر سعته 100 mL. املأ السحاحة بمحلول Na2S2O3 تركيزه معلوم Cr = 5,00×10-2 mol.L-1. ضع أسفل السحاحة البيشر الذي يحتوي على محلول I2، واسكب تدريجيا من السحاحة محلول Na2S2O3 قطرة قطرة مع التحريك، وفي كل إضافة اقرأ شدة التيار I المار في الدارة باستعمال جهاز قياس الناقلية الكهربائية ـ املأ الجدول التالي:
6,0 | 5,0 | 4,0 | 3,0 | 2,0 | 1,0 | 0,0 | Vr(mL) |
G(ms) | |||||||
13,0 | 12,0 | 11,0 | 10,0 | 9,0 | 8,0 | 7,0 | Vr(mL) |
G(ms) | |||||||
20,0 | 19,0 | 18,0 | 17,0 | 16,0 | 15,0 | 14,0 | Vr(mL) |
G(ms) |
الاجابة:
|
6,0 |
5,0 |
4,0 |
3,0 |
2,0 |
1,0 |
0,0 |
Vr(mL) |
|
2,63 |
3,0 |
3,35 |
3,68 |
4,03 |
4,42 |
4,81 |
G(ms) |
|
13,0 |
12,0 |
11,0 |
10,0 |
9,0 |
8,0 |
7,0 |
Vr(mL) |
|
1,92 |
1,74 |
1,55 |
1,49 |
1,71 |
2,0 |
2,3 |
G(ms) |
|
20,0 |
19,0 |
18,0 |
17,0 |
16,0 |
15,0 |
14,0 |
Vr(mL) |
|
3,45 |
3,25 |
3,01 |
2,78 |
2,55 |
2,33 |
2,11 |
G(ms) |
ـ أكمل بيانات الرسم؟
ـ ما هو لون محلول اليود قبل المعايرة ؟
لونه بني.
ـ ما لون محلول ثيوكبريتات الصوديوم؟
شفاف.
ـ علما أن الثنائيتين (مؤكسد/مرجع) الداخلة في التفاعل هما (S4O62-/S2O32-)، (I2/I-)
ـ أكتب المعادلة النصفية الإلكترونية للأكسدة ؟
S2O32-(aq)
= S4O62-(aq)+2é
ـ أكتب المعادلة النصفية الإلكترونية للإرجاع ؟
I2(aq) + 2é = 2I-(aq)
ـ أكتب معادلة الأكسدة الإرجاعية ؟
S2O32-(aq)
+ I2(aq) = 2I-(aq) + S4O62-(aq)
ـ حدد المؤكسد والمرجع في هذا التفاعل؟
المؤكسد: I2(aq)
المرجع: S2O32-(aq)
ـ أحسب كمية المادة لثنائي اليود قبل المعايرة ؟
no = CoVo
بالاستعانة بجدول تقدم التفاعل، أحسب كمية المادة للأجسام الداخلة في
التفاعل، والناتجة منه لكل حجم Vr مضاف من محلول Na2S2O3 بواسطة السحاحة، عندما Vr يأخذ القيم التالية: Vr = 12mL
، Vr = 5mL
- من أجل: Vr = 5mL
نلاحظ أن Vr
< Vre ومنه
جدول التقدم يكون كما يلي:
|
I2(aq) + 2S2O32-(aq) =
2I-(aq) + S4O62-(aq) |
معـادلة
التفاعل |
||||
|
كمـيات
المادة n(mol) |
التقدم |
حالة
الجملة |
|||
|
0 |
0 |
nr= CrVr |
no= CoVo |
0 |
الحالة
الابتدائية |
|
x |
2x |
CrVr-2x |
Co Vo – x |
x |
الحالة
الانتقالية |
|
xmax |
2xmax |
0 |
Co Vo – xmax |
xmax = CrVr/2 |
الحالة
النهائية |
ـ ما هو المتفاعل المحد للتفاعل؟
ثيوكبريتات الصوديوم Na2S2O3
- من أجل: Vr = 12 mL
نلاحظ أن Vr > Vre ومنه جدول التقدم يكون كما يلي:
|
I2(aq) + 2S2O32-(aq) =
2I-(aq) + S4O62-(aq) |
معـادلة
التفاعل |
||||
|
كمـيات
المادة n(mol) |
التقدم |
حالة
الجملة |
|||
|
0 |
0 |
nr= CrVr |
no= CoVo |
0 |
الحالة
الابتدائية |
|
x |
2x |
CrVr-2x |
Co Vo – x |
x |
الحالة
الانتقالية |
|
xmax |
2xmax |
Cr(Vr-Vre) |
0 |
xmax = CrVr/2 |
الحالة
النهائية |
ـ ما هو المتفاعل المحد في هذه الحالة ؟ هل تغير المتفاعل المحد؟
هو محلول اليود، نعم.
ـ أرسم البيان( G = f(Vr ، وحدد النقطة التي حدث فيها انقلاب إشارة تغير الناقلية ؟
ـ اشرح البيان في فقرة صغيرة ؟
المنحنى G = f(Vr)يحتوي على جزأين أساسين:
جزء متناقص من أجل 0 ≤ Vr ≤ 10,3 ml وجزء متزايد 10,3 ml ≤ Vr ≤ 20 ml
نسمي
النقطة المحددة بنقطة التكافؤ، ونرمز للحجم عند هذه النقطة بـ Vre، حيث Vre = 10,3 ml ، وتأخذ الناقلية عندها أصغر قيمة، وفيها يحدث تغير للمتفاعل المحد للتفاعل.
ـ املأ الجدول عند Vr = Vre أي في نقطة التكافؤ؟
|
I2(aq) + 2S2O32-(aq) =
2I-(aq) + S4O62-(aq) |
معـادلة
التفاعل |
||||
|
كمـيات
المادة n(mol) |
التقدم |
حالة
الجملة |
|||
|
0 |
0 |
nr= CrVr |
no= CoVo |
0 |
الحالة
الابتدائية |
|
x |
2x |
CrVr-2x |
Co Vo – x |
x |
الحالة
الانتقالية |
|
CrVre/2 |
CrVre |
CrVre-2xe= 0 |
CoVo-xe
= 0 |
xmax = CrVr/2 |
الحالة
النهائية |
ـ ما هي كمية مادة I2(aq) في نقطة التكافؤ؟
ـ ما هي كمية المادة S2O32-(aq) في نقطة التكافؤ؟
هي صفر (0).
ـ أوجد التقدم xe بدلالة Vre ، Cr ؟
ـ أوجد التقدم xe بدلالة Vo ، Co ؟
xe
= CoVo
ـ استنتج العلاقة CoVo = CrVre/2 عند نقطة التكافؤ، وأحسب Co تركيز محلول اليود I2(aq)؟
لدينا: xe = CoVo
ولدينا:
ومنه:
ومنه:
ومنه:
ـ هل يمكن استخدام قياس الناقلية لتحديد كمية مادة في محلول؟
نعم.
وثيقة التلميذ بصيغة الـ PDF









تعليقات
إرسال تعليق