تعيين كمية المادة عن طريق قياس الناقلية. الاجابة عن الأسئلة
تعيين كمية المادة عن طريق قياس الناقلية. الاجابة عن الأسئلة
ملاحظة: توجد وثيقة التلميذ بصيغة الـ PDF في نهاية المقال
I ـ تذكير بسيط حول المحاليل المائية وأنواعها:
ـ تحضير محلول شاردي:
أ ـ حالة المذاب جسم صلب شاردي:
نركب دارة كهربائية من مصباح، ومولد، ولبوسين
(سلكين غير معزولين):
- نضع كمية من بلورات KMnO4 في بيشر، ثم ندخل فيها اللبوسين كما في الشكل:
ـ ماذا تلاحظ ؟
نلاحظ عدم اشتعال المصباح برغم من غلق
الدارة الكهربائية، ومنه نستنتج
ـ نضيف كمية من الماء الى البيشر الذي يحتوي KMnO4 ـ ماذا تلاحظ ؟
نلاحظ اشتعال المصباح في هذه الحالة، وهذا دلالة على تحرر الشوارد K+ الشفافة، وشوارد MnO4- البنفسجية في المحلول الناتج، وبانتقالها فيه يسري التيار الكهربائي.
نعيد نفس التجربة باستعمال: السكر، NaCl، CuSO4 ـ ماذا تلاحظ ؟
السكر: نلاحظ أنه لا يمرر التيار الكهربائي، لأن جزيئاته تبقى متعادلة كهربائيا، ولا توجد حاملات الشحنة.
(CuSO4): نلاحظ أنه لا يمرر التيار لعدم انتقال الشوارد، أما عند انحلالها في الماء
وتشردها تصبح ناقلة للتيار.
:( NaCl) نلاحظ أنه لا يمرر التيار لعدم
انتقال الشوارد، أما عند انحلالها في الماء
وتشردها تصبح ناقلة للتيار.
ـ ما هي المحاليل التي تمرر التيار الكهربائي؟
هي المحاليل الشاردية فقط ـ الكهروليتات.
- بماذا تمتاز المحاليل المائية التي تمرر التيار
الكهربائي؟ وكيف نسميها ؟
تمتاز بخاصية الناقلية للكهرباء كونها محاليل شاردية، وتسمى بالمحاليل
الشاردية، أو الكهروليتات.
- بماذا تمتاز المحاليل المائية التي لا تمرر
التيار الكهربائي؟ وكيف نسميها ؟
تمتاز بخاصية عدم الناقلية كونها محاليل غير شاردية، وتسمى نتيجة لذلك بالمحاليل الجزيئية.
نتيجة:
في الجسم الصلب الشاردي، الشوارد تحتل مواقع معينة ولا تنتقل، فالجسم الصلب الشاردي معتدل كهربائيا، وعند انحلاله في الماء تنفصل الشوارد مكونة شحنات (شوارد) حرة الحركة في المحلول، فيكون حينئذ ناقلا للتيار الكهربائي. بينما السكر يحتوي على روابط تكافؤية، وعند انحلاله في الماء تنفصل جزيئاته، ولكنها تبقى متعادلة، فلا وجود لشحنات حرة في المحلول المائي الذي لا ينقل التيار الكهربائي.
ب ـ حالة المذاب سائل أو غاز مستقطب:
محلول كلور الهيدروجين يحتوي شوارد:
نملأ الوعاء إلى ثلثي حجمه بمحلول مائي لــ HCl، ثم نغمس فيه لبوسين من النحاس، ونصله على التسلسل مع أمبير متر، مولد، قاطعة.
ـ أرسم الدارة ؟
ـ هل المحلول يمرر التيار الكهربائي؟
نعم المحلول يمرر التيار
الكهربائي.
ـ هل محلول كلور الهيدروجين شاردي؟
نعم.
ـ أكتب معادلة التفاعل أثناء الإنحلال؟
HCl(g) + H2O(ℓ) →
H3O+(aq) + Cl-(aq)
يمر التيار في المحلول المائي لكلور الهيدروجين، ومنه نستنتج أن
انحلال غاز HCl في الماء، يصاحبه تشكل شاردة
الكلورCl-، وشاردة الهيدرونيومH3O+.
II ـ النقل الكهربائي للمحاليل الشاردية:
III ـ عبارة الناقلية في جزء من محلول شاردي:
1 ـ المقاومة:
2 ـ عبارة الناقلية G العائدة لمحلول شاردي:
تعرف الناقلية بأنها تمثل مقدار سماحية مرور التيار الكهربائي عبر ناقل كهربائي، أو جزء من محلول، أي أنها مقلوب المقاومة بحيث:
وحدتها السيمنس (S).
3 ـ مدخل لقياس الناقلية في محلول شاردي:
أ ـ تركيب خلية قياس الناقلية:
نسمي جملة الصفيحتين والفضاء المحدد بينهما، خلية قياس الناقلية (أنظر الشكل التالي):
ب ـ تحديد العوامل المؤثرة في الناقلية:
لقياس الناقلية لمحلول ما نقوم بحصر جزء (حجم)، من هذا المحلول بين صفيحتين معدنيتين متماثلتين، سطح كل منهما S، وتفصلهما مسافة L، ثم نطبق عليهما بواسطة مولد من نوع GBF، فرق في الكمون متناوب جيبي قيمته الفعالة Ueff، وتواتره f منخفض، مع وضع أمبيرمتر على التسلسل معه، لقياس القيمة الفعالة Ieff لشدة التيار المار عبر الجزء من المحلول (أنظر الشكل التالي):
التيار المتناوب الجيبي:
التواتر:
هو
عدد الاهتزازات، أو الدورات المنجزة خلال ثانية واحدة، نرمز له بالرمز f، ويقاس بالهرتز.مولد
التوترات المنخفضة GBF:
هو جهاز يولد إشارات كهربائية، يمكن
اختيار نوعها (جيبيه، مربعة، مثلثية)، وضبط سعتها بالفولط (V)، وتواترها بالهرتز(Hz)
ـ تأثير السطح (S) للخلية:
نأخذ محلولا شارديا من كلور الصوديوم (Na+ + Cl-) تركيزه ثابت C = 0,01 mol/L ،وحجمه V = 50 mL. ودرجة حرارة θ = 25°C.
L = 1 cm . نغير في (S) مساحة جزء اللبوس المغمور في المحلول، ونقيس في كل مرة ناقلية G للمحلول، ونسجل النتائج في الجدول التالي:
|
6 |
5 |
4 |
3 |
2 |
1 |
S(cm2) |
|
7.08 |
5.90 |
4.72 |
3.54 |
2.36 |
1.18 |
(G(mS |
|
|
G/S |
ـ أكمل الجدول السابق؟
ـ ماذا تلاحظ ؟
اتمام الجدول:
6 | 5 | 4 | 3 | 2 | 1 | S(cm2) |
7.08 | 5.90 | 4.72 | 3.54 | 2.36 | 1.18 | (G(mS |
1,18
| 1,18 | 1,18 | 1,18 | 1,18 | 1,18 | G/S |
نلاحظ أن G تزداد بزيادة S
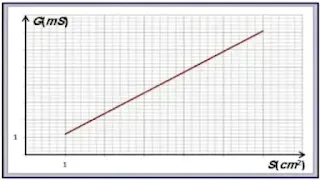
ـ أرسم البيان G = f(S) ؟
ـ ماذا تلاحظ ؟
نلاحظ أن البيان عبارة عن خط مستقيم يمر بالمبدأ.
ـ أكتب العلاقة التي تربط الناقلية G
بالسطح S للجزء المغمور في الخلية
؟
G = a.S
الناقلية G تتناسب طردا مع السطح S للبوسين.
ـ تأثير البعد L بين صفيحتي الخلية:
نأخذ محلولا شارديا من كلور الصوديوم (Na+ + Cl-) تركيزه ثابت C = 0,01 mol/L وحجمه V = 50 mL ودرجة حرارة θ = 25°C
S = 5 cm2. نغير في البعد L بين صفيحتي الخلية، ونقيس في كل مرة ناقلية المحلول، ونسجل النتائج في الجدول التالي:
|
5 |
4 |
2.5 |
2 |
1 |
0.5 |
(L(cm |
|
1.18 |
1.47 |
2.36 |
2.95 |
5.9 |
11.8 |
(G(mS |
|
|
1/L(cm-1) |
|||||
|
|
G×L |
|||||
|
|
G/L |
ـ أكمل الجدول السابق؟
ـ ماذا تلاحظ ؟
إتمام الجدول:
5 | 4 | 2.5 | 2 | 1 | 0.5 | (L(cm |
1.18 | 1.47 | 2.36 | 2.95 | 5.9 | 11.8 | (G(mS |
0,2 |
0,25 | 0,4 | 0,5 | 1 | 2 | 1/L(cm-1) |
5,9 | 5,88 | 5,9 | 5,9 | 5,9 | 5,9 | G×L |
0,236
| 0,367 | 0,944 | 1,475 | 5,9 | 23,6 | G/L |
نلاحظ أن L تزداد، G تتناقص.
ـ أرسم البيان G =
f(1/L) ؟
الإجابة:
نستنتج ان الناقلية G متناسبة
طردا مع مقلوب البعد بين الصفيحتين.
ـ أكتب العلاقة التي تربط الناقلية G بالبعد L بين الصفحتين؟
العلاقة التي تربط الناقلية G بالبعد L بين الصفحتين:
نتيجة عامة:
مما سبق نستنتج أن ناقلية محلول شاردي، متناسبة طردا مع سطح المسريين S، وعكسيا مع البعد بينهما L.
ونكتب:
ـ علاقة الناقلية G بالتركيز C للمحلول (مخطط المعايرة لخلية قياس الناقلية):
نحقق التركيب التجريبي لقياس الناقلية:
ـ محلول لكلور الصوديوم تركيزه 10-1
mol.L-1 (المحلول الأب).
ـ خلية قياس الناقلية، فولتمتر، أمبير متر، مولد GBF
ـ أنابيب اختبار، بيشر.
نحضر من المحلول الأب عدة محاليل ممددة لها نفس الحجم 100 mL ، ومختلفة التركيز، نقيس شدة التيار والتوتر، ثم نحسب الناقلية G بالنسبة لكل محلول، ونسجل النتائج في الجدول التالي:
|
10 |
8 |
6 |
4 |
2 |
C×10-3mol.L-1 |
|
81 |
63 |
48 |
35 |
18 |
(I(mA |
|
11.4 |
11,5 |
11,8 |
12,0 |
12,2 |
U(V) |
|
|
|
|
|
|
(G = I/U (mS |
|
20 |
18 |
16 |
14 |
12 |
C×10-3mol.L-1 |
|
155 |
140 |
123 |
107 |
95 |
(I(mA |
|
11.0 |
11,1 |
11,2 |
11,2 |
11,3 |
U(V) |
|
|
|
|
|
|
(G = I/U (mS |
1 ـ أكمل الجدول السابق؟
الإجابة:
|
10 |
8 |
6 |
4 |
2 |
C×10-3mol.L-1 |
|
7,0 |
5,6 |
4,2 |
2,9 |
1,5 |
(G = I/U (mS |
|
20 |
18 |
16 |
14 |
12 |
C×10-3mol.L-1 |
|
14,1 |
12,6 |
11,1 |
9,7 |
8,4 |
(G = I/U (mS |
2 ـ أرسم البيان (G = f(C باستعمال سلم رسم مناسب؟
ـ ماذا تستنتج؟
الإجابة:
3 ـ أوجد
العلاقة البيانية G = f(C) ؟
نلاحظ أن البيان عبارة عن خط مستقيم امتداده يمر من المبدأ ومنه: G = a.C حيث: a معامل توجيه المنحنى البياني.
ونكتب:
وبالتعويض نجد:
ومنه:
إذن:
4 ـ لدينا محلول ممدد لكلور الصوديوم تركيزه مجهول، هل يمكن تحديد تركيزه المولي من خلال العمل المنجز سابقا ؟ اذا كان الجواب بنعم
ـ أذكر الطريقة المتبعة لتحقيق ذلك ؟
نعم يمكننا ذلك، حيث مخطط معايرة خلية قياس الناقلية يمكننا من
تحديد تركيز محلول لكلور الصوديوم الممدد مجهول التركيز، حيث نقوم فقط بقياس ناقلية
المحلول، ثم نطبق العلاقة المتحصل عليها من البيان.
جـ ـ الناقلية النوعية لمحلول شاردي:
ـ من البيانين G = f(S)، G = f(1/L) نجد أن:
المقدارS/L يميز الخلية المستعملة في القياس، ويسمى ثابت الخلية، ونرمز له بالرمز k ويقاس بالمتر(m)
نسمي المقدارσ الناقلية النوعية للمحلول، وتقاس بالسيمنس على المتر (S/m)
، ونكتب: G = k.σ
ـ ومن البيان G =
f(C) نجد: G = k'.C حيث k' لا يمثل ثابت الخلية.
بما أن G متناسبة طردا مع C، فان σ متناسبة طردا مع C، ومنه نكتب: σ = λ.C
حيث: λ : الناقلية النوعية المولية للمحلول الشاردي.
د ـ الناقلية النوعية المولية لمحلول شاردي:
لدينا العلاقة:
حيث أن I ناتج عن حركتي الشحنات (الشوارد) الموجبة والسالبة، في اتجاهين متعاكسين، ومنه نعبر عن التيار الكلي بالعبارة: I = I(X+) + I(X-)
و نجد أن:
ومنه: G = G(X+) + G(X-) حيث: G(X+): ناقلية الشحنات الموجبة، G(X-): ناقلية الشحنات السالبة.
وبما أن σ متناسبة طرديا مع G، يمكن كتابة العلاقة: σ = σ(X+) + σ(X-)
ولدينا: σ = λ.C ، ومنه نكتب: σ = λ(X+).C + λ(X-).C ، أي:
σ = [λ(X+) + λ(X-)].C
ومنه نجد: λ = λ(X+) + λ(X-)
الناقلية النوعية المولية الشاردية للمحلول (λ). تساوي مجموع الناقليتين النوعيتين الموليتين للشاردتين الموجبة والسالبة، المتواجدتين في المحلول:
هـ ـ قانون كولروش:
اذا كان لدينا محلول يحتوي على عدة شوارد مختلفة، نعبر عن الناقلية النوعية بعبارة كولروش:
ملاحظة:
الناقلية
النوعية المولية الشاردية λ للشاردة، مقدار فيزيائي خاص بكل
شاردة، ولا يتعلق الا بدرجة الحرارة.
الناقلية النوعية المولية لبعض الشوارد عند θ = 25°C:
|
λi(mS.m2.mol-1) |
المصعديات |
λi(mS.m2.mol-1) |
المهبطيات |
|
19,9 |
HO- |
35,0 |
H3O+ |
|
7,63 |
Cl- |
5,01 |
Na+ |
|
7,81 |
Br - |
7,35 |
K+ |
|
7,70 |
I- |
7,35 |
NH4+ |
|
6,10 |
MnO4- |
6,19 |
Ag+ |
|
7,14 |
NO3- |
11,9 |
Ca2+ |
4 ـ معايرة مصل فيزيولوجي
(التحقق من دلالته التجريبية):
نريد في هذه الدراسة أن نحدد كمية المادة لكلور الصوديوم NaCl، المنحلة في 1Lمن المصل الفيزيولوجي، عن طريق قياس الناقلية G للمحلول، ومقارنتها مع القيم المدونة على العلبة، (أنظر الصورة) للتأكد من مدى احترام الصانع لمعايير الجودة.
1 ـ معايرة خلية قياس الناقلية، المستعملة في قياس ناقلية المصل الفيزيولوجي، وتتم وفق الخطوات التالية:
ـ تحضر محاليل قياسية من كلور الصوديوم تراكيزها:
10-3 mol.L-1
< C < 10-2 mol.L-1
ـ قياس الناقلية
G لجزء من هذه المحاليل المحصورة بين لبوسي خلية القياس.
ـ رسم البيان G = f(C) (مخطط معايرة خلية قياس الناقلية).
2 ـ تخفيف
المصل الفيزيولوجي (Sérum)، ثم قياس ناقليته بنفس خلية قياس الناقلية المستعملة، وفي نفس درجة
الحرارة، ومطابقة قيمتها على المخطط G = f(C)، واستنتاج قيمة التركيزC لمحلول المصل المخفف، والمحلول
الأصلي.
3 ـ حساب كمية المادة، والكتلة في 1 L من المصل الفيزيولوجي، ومقارنتها مع القيمتين المكتوبتين على العينة، ثم استنتاج مدى احترام الصانع لمعايير الجودة.
وثيقة التلميذ بصيغة الـ PDF







تعليقات
إرسال تعليق