حلول تمارين الكتاب المدرسي حول المتابعة الزمنية لتحول كيميائي
حلول تمارين الكتاب المدرسي حول المتابعة الزمنية لتحول كيميائي
المتابعة الزمنية لتحول كيميائي، هي عملية تتبع تغيرات المواد المتفاعلة، والنواتج مع مرور الوقت خلال تفاعل كيميائي. يهدف هذا الموضوع إلى فهم سرعة التفاعل، وكيفية تطوره باستخدام أساليب قياس التركيز، الضغط، ودرجة الحرارة. من خلال حلول تمارين الكتاب المدرسي، يتمكن الطلاب من تطبيق المفاهيم النظرية على مسائل عملية، مما يعزز فهمهم لكيفية مراقبة تطور التفاعل، واستخلاص البيانات المتعلقة بالسرعة والزمن.
حل التمرين 1 صفحة 48 من وحدة المتابعة الزمنية:
1 ـ يدل الصدأ على أن الحديد تفاعل مع ثنائي الأكسجين.
2 ـ معادلة التفاعل الكيميائي:
4Fe + 3O2
→ 2Fe2O3
3 ـ تفاعل من بطيء الى بطيء جدا.
حل التمرين 2 صفحة 48 من وحدة المتابعة الزمنية:
1 ـ الثنائيتان هما:
I2/I- و S4O62-/S2O32-
2 ـ المعادلتان النصفيتان الالكترونيتان هما:
I2 + 2e- =
2I-
2S2O32- = S4O62-
+ 2e-
3 ـ معادلة الأكسدة ـ ٳرجاع:
I2 + 2S2O32-
= 2I- + S4O62-
4 ـ قبل التكافؤ يزول لون ثنائي اليود كلما امتزج مع ثيوكبريتات الصوديوم، (ثنائي اليود هو المتفاعل المحد)، وبعد نقطة التكافؤ يبدا اللون البني في الظهور.
حل التمرين 3 صفحة 48 من وحدة المتابعة الزمنية:
1 ـ يحدث التفاعل بين الثنائيتين:
I2/I- و S2O82-/SO42-
2 ـ المعادلتان النصفيتان:
2I- = I2 + 2e-
S2O82-
+ 2e- = 2SO42-
3 ـ معادلة الأكسدة ـ ٳرجاع:
2I-(aq)
+ S2O82-(aq) = I2(aq) +
2SO42-(aq)
4 ـ سبب ظهور اللون الأسمر هو تشكل ثنائي اليود I2
حل التمرين 4 صفحة 48 من وحدة المتابعة الزمنية:
1 ـ الغاز المنطلق هو O2
2 ـ المؤكسد هو MnO4- والمرجع هو H2O2
الثنائيتان هما:
MnO4-/Mn2+ و O2/H2O2
المعادلتان النصفيتان الالكترونيتان هما:
2(MnO4-(aq) + 8H+(aq)
+ 5e- = Mn2+(aq) + 4H2O(l))
5(H2O2(aq) = O2(g) +
2H+(aq) + 2e-)
معادلة الأكسدة ـ ٳرجاع:
2MnO4-(aq) + 5H2O2(aq)
+ 6H+(aq) = 2Mn2+(aq) + 5O2(g)
+ 8H2O(l)
حل التمرين 5 صفحة 48 من وحدة المتابعة الزمنية:
1 ـ الغاز المنطلق هوH2
2 ـ المرجع هو الصوديوم Na، المؤكسد هو الماء H2O
3 ـ الثنائيتان هما: Na+/Na و H2O/H2
المعادلتان النصفيتان الالكترونيتان هما:
2(Na = Na+ +
e-)
2H2O + 2e- = H2 + 2OH-
معادلة الأكسدة ـ ٳرجاع:
2Na(s)
+ 2H2O(l) = 2Na+(aq) + 2OH-(aq)
+ H2(g)
حل التمرين 6 صفحة 48 من وحدة المتابعة الزمنية:
1 ـ الثنائيتان هما:
Cu2+/Cu و Fe2+/Fe
المعادلتان النصفيتان الالكترونيتان هما:
Cu2+(aq) +
2e- = Cu(S)
Fe(S) = Fe2+(aq)
+ 2e-
معادلة الأكسدة ـ ٳرجاع:
Cu2+(aq) + Fe(S) = Fe2+(aq)
+ Cu(S)
2 ـ يدل زوال اللون الأزرق على أن كل شوارد النحاس الثنائي قد تحولت الى
ذرات نحاس.
ـ هذا التفاعل بطيء.
3 ـ نكشف عن الشوارد المتشكلة بإضافة محلول هيدروكسيد الصوديوم، فيتشكل راسب
أخضر لهيدروكسيد الحديد الثنائي.
حل التمرين 7 صفحة 48 من وحدة المتابعة الزمنية:
1 ـ الثنائيتان هما:
MnO4-/Mn2+ و O2/H2O2
2 ـ المعادلتان النصفيتان الالكترونيتان هما:
2(MnO4-(aq) + 8H+(aq)
+ 5e- = Mn2+(aq) + 4H2O(l))
5(H2O2(aq) = O2(g) +
2H+(aq) + 2e-)
معادلة الأكسدة ـ ٳرجاع:
2MnO4-(aq)+ 5H2O2(aq)+ 6H+(aq) = 2Mn2+(aq) + 5O2(g)+ 8H2O(l)
3 ـ عند نقطة التكافؤ يظهر اللون البنفسجي لبرمنغنات البوتاسيوم.
4 ـ جدول التقدم:
|
2MnO4-(aq) + 5H2O2(aq) + 6H+(aq) = 2Mn2+(aq) + 5O2(g)
+ 8H2O(l) |
معادلة
التفاعل |
||||||
|
كمـــيات
المادة n(mol) |
التقدم x(mol) |
حالة
الجملة |
|||||
|
بزيادة |
0 |
0 |
/ |
n0(H2O2) |
n0(MnO4-) |
0 |
الحالة الابتدائية |
|
بزيادة |
5x |
2x |
/ |
n0(H2O2)-5x |
n0(MnO4-)
-2x |
x |
الحالة الانتقالية |
|
بزيادة |
5Xf |
2Xf |
/ |
n0(H2O2)-5Xf |
n0(MnO4-)
-2Xf |
Xf |
الحالة النهائية |
5 ـ
6 ـ
\[ C = \frac{5}{2} \cdot \frac{C' V_E'}{V} \]حل التمرين 8 صفحة 49 من وحدة المتابعة الزمنية:
1 ـ الثنائيتان هما:
Mg2+(aq)/Mg(S) و H+(aq)/H2(g)
المعادلتان النصفيتان الالكترونيتان هما:
Mg(S) = Mg2+(aq)
+ 2e-
2H+(aq) + 2e- = H2(g)
معادلة الأكسدة ـ إرجاع:
Mg(S) + 2H+(aq) = Mg2+(aq)
+ H2(g)
2 ـ نحسب n0(H+) ، n0(Mg) فنجد:
n0(H+) = C1V1 = 10-2 mol
ثم نقوم بإنجاز جدول التقدم:
|
Mg(S) +
2H+(aq) = Mg2+(aq) + H2(g) |
معـــادلة التفاعل |
||||
|
كمـــيات المادة (mol) |
التقدم |
حـــالة الجملة |
|||
|
0 |
0 |
10-2 |
1,5×10-3 |
0 |
الحـالة الابتدائية |
|
x |
x |
10-2 – 2x |
1,5×10-3 - x |
x |
الحـالة الانتقالية |
|
Xf |
Xf |
10-2 – 2Xf |
1,5×10-3
- Xf |
Xf |
الحـالة النــهائية |
من جدول التقدم نجد: Xmax = 1,5×10-3 mol
وبالاعتماد على المعطيات نجد عند 15 min:
نلاحظ أن n(H2) < Xmax ومنه التفاعل لم ينتهي بعد عند 15 min
حل التمرين 9 صفحة 49 من وحدة المتابعة الزمنية:
من أجل التفاعل: aA + bB = cC + dD نجد:
ومنه:
\[ v_C = \frac{c \cdot v_A}{a} \]ومنه من أجل 2A + B = C + D نجد:
منسق:
حل التمرين 10 صفحة 49 من وحدة المتابعة الزمنية:
1 ـ التفاعل الكيميائي الحادث بطيء
2 ـ لدينا:
ولدينا:
n(MnO4-) =
C.V = 0,01×0,05
ومنه:
n(MnO4-)
= 5×10-4mol
ومنه:
حل التمرين 13 صفحة 50 من وحدة المتابعة الزمنية:
1 ـ انجاز جدول التقدم للتفاعل:
|
H2O2(aq)
+ 2I-(aq) + 2H+(aq) = I2(aq)
+ 2H2O(l) |
معـــادلة التفاعل |
||||
|
كمـــيات المادة (mol) |
التقدم |
حـــالة الجملة |
|||
|
بزيادة |
0 |
n0(I-) |
n0(H2O2) |
0 |
الحـالة الابتدائية |
|
بزيادة |
x |
n0(I-) – 2x |
n0(H2O2) – x |
x |
الحـالة الانتقالية |
|
بزيادة |
Xf |
n0(I-) – 2Xf |
n0(H2O2) – Xf |
Xf |
الحـالة النهائية |
2 ـ حساب التقدم x من أجل مختلف الأزمنة:
من جدول التقدم نجد: n(I2) = x ولدينا: n(I2) = [I2].V
ومنه: x = 0,2[I2]
|
120 |
60 |
40 |
30 |
20 |
16 |
12 |
8 |
6 |
4 |
2 |
1 |
0 |
t(min) |
|
1,74 |
1,74 |
1,70 |
1,64 |
1,54 |
1,46 |
1,32 |
1,10 |
0,92 |
0,74 |
0,42 |
0,22 |
0 |
x(mmol) |
رسم المنحنى الممثل لـ x = f(t) : ( لاحظ الشكل)

3 ـ أ/ السرعة الحجمية للتفاعل هي سرعة التفاعل في وحدة الحجوم وتعطى بالعلاقة:
ايجاد
السرعة الحجمية عند t = 0:
لدينا:
حيث:
-
هو ميل المماس عند
نحسب السرعة الحجمية الابتدائية كما يلي:
ومنه:
ايجاد
السرعة الحجمية عند t = 10
min:
بالاعتماد على البيان وبنفس الطريقة السابقة نجد:
ب ـ يمكن القول عن السرعة
عند t = 100 min أنها معدومة لأن كمية المادة تصبح ثابتة.
جـ ـ نفسر تناقص سرعة
التفاعل بتناقص تراكيز المتفاعلات.
حل التمرين 14 صفحة 50 من وحدة المتابعة الزمنية:
1 ـ الثنائيتان هما:
MnO4-/Mn2+ و CO2/H2C2O4
المعادلتان النصفيتان الالكترونيتان هما:
2(MnO4-(aq) + 8H+(aq)
+ 5e- = Mn2+(aq) + 4H2O(l))
5(H2C2O4(aq) = 2CO2(g)
+ 2H+(aq) + 2e-)
معادلة الأكسدة ـ ٳرجاع:
2MnO4-(aq)+5H2C2O4(aq)+6H+(aq)=2Mn2+(aq)+10CO2(g)+ 8H2O(l)
2/ n0(MnO4-)
= 5×10-5 mol
n0(H2C2O4) = 5×10-3
mol
3/ نقوم بإنجاز جدول التقدم للتفاعل، وبالاعتماد على الحالة النهائية نحسب التقدم الاعظمي للتفاعل، حيث نضع n0(MnO4-) - 2Xmax = 0 ،
ثم نضع n0(H2C2O4) – 5Xmax = 0
ومنه نجد: Xmax = 2,5×10-5
mol
نلاحظ أننا نحتاج لهذا التفاعل n(H2C2O4)
= 5Xmax = 12,5×10-5 mol
ونحن لدينا: n0(H2C2O4)
= 5×10-3 mol ، ومنه كمية مادة الحمض
المستعمل تكفي لزوال لون شوارد البرمنغنات في المزيج.
4 ـ حساب السرعة الحجمية لتشكل شوارد المنغنيز:

السرعة الحجمية تمثل ميل المماس للبيان عند النقطة المقصودة ومنه نجد:
عند t1 = 80 s:
v1(vol) = 3,84×10-7 mol.L-1.s-1
عند t2 = 200 s:
v2(vol) = 3,75×10-6 mol.L-1.s-1
عند t3 = 280 s:
v3(vol) = 3,38×10-7 mol.L-1.s-1
حل التمرين 15 صفحة 51 من وحدة المتابعة الزمنية:
1 ـ معادلة تفاعل المعايرة:
الثنائيتان هما:
I2/I- ، S4O62-/S2O32-
المعادلتان النصفيتان الالكترونيتان هما:
I2 + 2e- =
2I-
2S2O32- = S4O62-
+ 2e-
معادلة الأكسدة ـ ٳرجاع:
I2 + 2S2O32-
= 2I- + S4O62-
2 ـ ايجاد العلاقة بين كمية مادة اليود والحجم V' :
انجاز جدول التقدم للتفاعل:
|
I2 +
2S2O32- = 2I- + S4O62- |
معادلة التفاعل |
||||
|
كمـــيات المادة (mol) |
التقدم |
حـالة الجملة |
|||
|
0 |
0 |
n0(S2O32-) |
n0(I2) |
0 |
الحالة الابتدائية |
|
x |
2x |
n0(S2O32-)
– 2x |
n0(I2)-x |
x |
الحالة الانتقالية |
|
xE |
2xE |
n0(S2O32-)
– 2xE |
n0(I2)-xE |
xE |
الحالة النهائية |
عند التكافؤ نجد:
n0(I2) – xE = 0 و n0(S2O32-) – 2xE = 0
ومنه نجد: xE = n0(I2) و xE = ½n0(S2O32-)
ومنه: n(I2) = ½n0(S2O32-) حيث: n0(S2O32-) = C'.V'
ومنه: n(I2) = ½ C'.V'
ولدينا: C' = 10-1
mol.L-1 ومنه: n(I2) =
0,05V'
3 ـ رسم بيان n(I2) = f(t)
(تم استخدام المزيج الكلي)

4 ـ أ/ ايجاد قيمة السرعة الحجمية المتوسطة لتشكل I2 :
لدينا:
حيث:
يمثّل ميل المستقيم القاطع للبيان عند النقطتين الموافقتين للحظتين و .
نقوم بالتعويض:
ومنه:
ب ـ إيجاد قيمة السرعة الحجمية اللحظية لتشكل I2 :
حيث أن \( \frac{dn(I_2)}{dt} \) يمثل ميل المماس للبيان عند النقطة الموافقة للحظة \( t = 15 \, \text{min} \).
ومنه:
ومنه:
vvol = 1,71×10-4 mol.L-1.min-1
5 ـ أ/ كتابة معادلة التفاعل الكيميائي الحادث:
الثنائيتان هما: I2/I- و S2O82-/SO42-
المعادلتان النصفيتان:
2I- = I2 + 2e-
S2O82-
+ 2e- = 2SO42-
معادلة الأكسدة ـ إرجاع:
2I-(aq)
+ S2O82-(aq) = I2(aq) +
2SO42-(aq)
ب ـ استنتاج العلاقة بين سرعة إختفاء S2O82- وسرعة التفاعل:
ننجز جدول التقدم للتفاعل:
|
2I-(aq) + S2O82-(aq) = I2(aq) + 2SO42-(aq) |
معادلة التفاعل | ||||
|
كمـيات المادة n(mol) |
التقدم |
حالة الجملة | |||
|
0 |
0 |
n0(S2O82-) |
n0(I-) |
0 |
الحالة الابتدائية |
|
2x |
x |
n0(S2O82-)-x |
n0(I-) – 2x |
x |
الحالة الانتقالية |
|
2Xf |
Xf |
n0(S2O82-)-Xf |
n0(I-) – 2Xf |
Xf |
الحالة النهائية |
من جدول التقدم نجد:
n(S2O82-) = n0(S2O82-) –
x
ومنه:
ومنه:
ومنه سرعة اختفاءS2O82- تساوي
سرعة التفاعل
جـ ـ حساب السرعة الحجمية
للتفاعل عند t = 15 min:
ومنه:
vvol = 1,71×10-4 mol.L-1.min-1
حل التمرين 16 صفحة 51 من وحدة المتابعة الزمنية:
1 ـ كتابة معادلة التفاعل الكيميائي الحادث:
لدينا الثنائيتان (ox/réd) هما:
H+/H2 ، Zn2+/Zn
المعادلتان النصفيتان:
Zn(S)
= Zn2+(aq) + 2e-
2H+(aq)
+ 2e- = H2(g)
معادلة الاكسدة الإرجاعية:
Zn(S)
+ 2H+ = Zn2+(aq) + H2(g)
2 ـ جدول التقدم:
|
Zn(S) + 2H+ =
Zn2+(aq) + H2(g) |
معـادلة التفاعل |
||||
|
كمـيات المادة n(mol) |
التقدم |
حالة الجملة |
|||
|
0 |
0 |
n0(H+) |
n0(Zn) |
0 |
الحالة الابتدائية |
|
x |
x |
n0(H+)-2x |
n0(Zn)-x |
x |
الحالة الانتقالية |
|
Xf |
Xf |
n0(H+)-2Xf |
n0(Zn)-Xf |
Xf |
الحالة النهائية |
تعيين المتفاعل المحد:
من أجل: n0(H+) –2Xmax = 0 نجد: Xmax = ½ n0(H+)
ومنه: Xmax = ½CA.V
ومنه:
Xmax = ½ 0,2×0,1 = 0,01
mol
ومن أجل: n0(Zn) –Xmax = 0 نجد: Xmax = n0(Zn)
ومنه: Xmax = m/M
ومنه: Xmax = 2,3/65
ومنه: Xmax = 0,035 mol
نلاحظ أن: 0,01˂ 0,035 ومنه Xmax = 0,01 mol والمتفاعل المحد هو حمض كلور الهيدروجين.
استنتاج
العلاقة بين [Zn2+] و x :
x =
0,1[Zn2+]
3 ـ تعريف زمن نصف
التفاعل:
نرمز له بالرمز t1/2 وهو الزمن اللازم لبلوغ تقدم التفاعل نصف قيمته
النهائية أو الأعظمية.
تعيين
قيمة زمن نصف التفاعل:

بالاعتماد على البيان نجد: t1/2 = 4,5 min
4 ـ تعيين تركيب الوسط التفاعلي عند t = t1/2
بالاعتماد على البيان نجد:
n(Zn2+) = 50×10-3×0,1 = 5×10-3 mol
ولدينا: n(Zn2+) = x ومنه x = 5×10-3 mol
ومنه: n(Zn) = 3,5×10-2 - 5×10-3 = 3×10-2 mol
ومنه: n(H+) = 2×10-2 - 10×10-3 = 10-2
mol
تعيين
تركيب الوسط التفاعلي عند t = tf:
من البيان نجد: [Zn2+]f = 0,1 mol.L-1
ومنه: nf(Zn2+) = [Zn2+]f.V =
0,1×0,1 = 10-2 mol
ومنه: x = 10-2 mol
ومنه: n(Zn) = 3,5×10-2 - 10-2 = 2,5×10-2 mol
ومنه: n(H+) = 2×10-2 - 2×10-2 = 0
5 ـ تعيين السرعة الحجمية للتفاعل عند t = 0:
نرسم المماس للبيان عند
المبدأ:

لدينا: x = n(Zn2+) ومنه: vvol تمثل ميل المماس عند المبدأ. أي:
ـ تعيين السرعة الحجمية للتفاعل عند t = t1/2:
نرسم المماس للبيان عند النقطة
الموافقة للحظة t = t1/2:
(أنظر البيان السابق)
من البيان نجد:
التمرين 19 صفحة 52 من وحدة المتابعة الزمنية مع الحل:
عند درجة الحرارة 20°C وفي دورق (بالون) حجمه V = 500 mL نتابع باستعمال جهاز قياس الضغط التحول الذي يحدث بين حجم V'= 200 ml المحلول حمض كلور الهيدروجين (H+(aq)+ Cl-(aq)) ذي التركيز المولي C = 1,0×10-1 mol/L
.وكتلة m(Mg) = 9,0cg من المغنيزيوم ،
معادلة التفاعل المنمذج للتحول الكيميائي الحادث هي:
Mg(s) + 2H+(aq)=Mg2+(aq)
+ H2(g)
يعطى:
R = 8,31 j.K-1.mol-1; M(Mg)= 24,3g.mol-1
1
ـ ما هي النواتج المتشكلة خلال هذا التحول ؟
2 ـ
احسب كميات المادة الابتدائية للمتفاعلات
3 ـ
ما هو المتفاعل المحد ؟ علل.
4 ـ
الضغط الجوي في شروط التجربة
Patm = 1,009 × 105 Pa. نقيس الضغط P للغاز الموجود في الدورق في أزمنة مختلفة،
وتعطى قيمته بالعلاقة:
P = Patm + PH2
نتحصل
على جدول القياسات التالي:
|
144 |
115 |
90 |
71 |
52 |
18 |
0 |
t(s) |
|
1,239 |
1,198 |
1,159 |
1,127 |
1,097 |
1,034 |
1,009 |
P(105Pa) |
|
290 |
266 |
238 |
212 |
193 |
174 |
160 |
t(s) |
|
1,297 |
1,297 |
1,297 |
1,297 |
1,294 |
1,273 |
1,261 |
P(105Pa) |
أوجد العبارة الحرفية للتقدم x بدلالة PH2
5 ـ مثل بيان تغيرات التقدم x
بدلالة الزمن.
سلم الرسم:
للفواصل1cm ↔ 20 s
للتراتيب
1cm ↔ 4×10-4 mol
6 ـ عين زمن نصف التفاعل.
7 ـ عين السرعة الحجمية للتفاعل في اللحظة t = 180
s
8 ـ عين عند اللحظة t = 180 s ، حجم ثنائي
الهيدروجين المتشكل، والتركيز المولي لشوارد Mg2+(aq) في الوسط التفاعلي.
الحل:
1 ـ النواتج خلال هذا التحول هي:
شوارد المغنيزيوم (Mg2+) وثنائي الهيدروجين (H2)
2 ـ حساب كمية المادة
الابتدائية للمتفاعلات:
n0(HCl) = n0(H+) = CV' = 0,1×0,2 = 2,0×10-2 mol
3 ـ تحديد المتفاعل المحد:
بالاعتماد على جدول التقدم
Mg(S) + 2H+(aq) = Mg2+(aq) + H2(g) | معـــادلة التفاعل | ||||
كمـــيات المادة (mol) | التقدم | حـــالة الجملة | |||
0 | 0 | 2×10-2 | 3,7×10-3 | 0 | الحـالة الابتدائية |
x | x | 2×10-2 – 2x | 3,7×10-3 - x | x | الحـالة الانتقالية |
Xf | Xf | 2×10-2 - 2Xf | 3,7×10-3 - Xf | Xf | الحـالة النــهائية |
نضع:
3,7×10-3-(Xmax)1 = 0
ومنه نجد:
(Xmax)1 = 3,7×10-3 mol
ونضع:
2,0×10-2-2(Xmax)2 = 0
ومنه نجد:
(Xmax)2
= 10-2 mol
نلاحظ أن:
(Xmax)1 < (Xmax)2
ومنه:
Xmax = 3,7×10-3 mol
ومنه المتفاعل المحد هو: المغنيزيوم Mg
4 ـ ٳيجاد العبارة الحرفية
للتقدم x بدلالة P(H2):
لدينا: P(H2) = P – Patm وحسب قانون الغاز المثالي لدينا: P(H2).V = nRT
حيث n كمية المادة من ثنائي الهيدروجين عند اللحظة t ، أي أن n = x
ومنه نجد: (P – Patm).V = x.RT ومنه:
5 ـ تمثيل بيان تغيرات التقدم x بدلالة الزمن:
بالاعتماد على العلاقة (1) حيث:
V = 500 – 200 = 300 ml = 3,0×10-4 m3
T = 20 + 273 = 293 °K نتحصل على الجدول التالي:
|
144 |
115 |
90 |
71 |
52 |
18 |
0 |
t(s) |
|
2,83 |
2,32 |
1,84 |
1,45 |
1,10 |
0,31 |
0 |
x(mmol) |
|
290 |
266 |
238 |
212 |
193 |
174 |
160 |
t(s) |
|
3,54 |
3,54 |
3,54 |
3,54 |
3,50 |
3,24 |
3,10 |
x(mmol) |
بالاعتماد على مقياس الرسم على كل محور، بالنسبة للفواصل: 1 cm → 20 s ،
بالنسبة للتراتيب:
1 cm → 4×10-4 mol
نتحصل على الجدول
المساعد التالي:
|
7,2 |
5,8 |
4,5 |
3,6 |
2,6 |
0,9 |
0 |
t(cm) |
|
7,1 |
5,8 |
4,6 |
3,6 |
2,8 |
0,8 |
0 |
x(cm) |
|
14,5 |
13,3 |
11,9 |
10,6 |
9,6 |
8,7 |
8,0 |
t(cm) |
|
8,8 |
8,8 |
8,8 |
8,8 |
8,8 |
8,1 |
7,8 |
x(cm) |
ومنه نتحصل على البيان التالي:

6 ـ تعيين زمن نصف التفاعل:
من البيان نجد:
Xmax = 8,8×4×10-4 = 3,52×10-3 mol = 3,52 mmol
ومنه: Xmax/2 = 1,76 ≈ 1,8 mmol
بقسمة
1,8×10-3
على مقياس الرسم
4×10-4
نجد: 4,5 ، نعين 4,5 على محور التراتيب، ثم نسقط على البيان، ثم نسقط شاقوليا على محور الفواصل فنجد القيمة 2,2 ، نقوم بالضرب في مقياس الرسم على محور الفواصل فنجد:
t1/2 = 2,2×40 = 88 s
7 ـ تعيين السرعة الحجمية للتفاعل في اللحظة t = 180 s :
نرسم المماس عند النقطة من البيان ذات الفاصلة t = 180 s
ومنه:
8
ـ إيجاد حجم ثنائي الهيدروجين المتشكل عند اللحظة t = 180 s:
من البيان نجد أنه عند اللحظة t = 180 s تكون قيمة التقدم x = 3,4 mmol ،
ومن جدول التقدم نجد: n(H2) = x ،
ومن قانون الغاز المثالي نجد:
ومنه:
لدينا: n(H2) = V(H2)/V0 ومنه:
V(H2) = 24,13×3,4×10-3 = 82×10-3 L
حساب التركيز المولي لشوارد Mg2+:
لدينا: n(Mg2+) = x = 3,4 mmol ومنه:
حل التمرين 26 صفحة 56 من وحدة المتابعة الزمنية:
1 ـ أ ـ إيجاد كمية مادة H2O2 المتبقية عند t = 10 min:
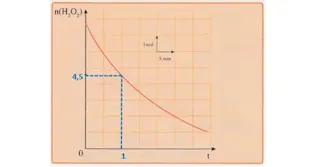
من البيان نجد:
n(H2O2) = 4,5 mol
ب ـ التركيب المولي للمزيج عند t = 10 min:
لدينا جدول التقدم
للتفاعل:
|
2H2O2(aq) =
O2(g) + 2H2O(l) |
معـادلة التفاعل | |||
|
كمـــيات المادة n(mol) |
التقدم |
حالة الجملة |
||
|
0 |
0 |
n0(H2O2) |
0 |
الحالة الابتدائية |
|
2x |
x |
n0(H2O2)-2x |
x |
الحالة الانتقالية |
|
2Xf |
Xf |
n0(H2O2)-2Xf |
Xf |
الحالة النهائية |
من جدول التقدم نجد:
n(H2O2) = n0(H2O2) –2x
حيث:
n0(H2O2) = 7,8
ومنه: 4,5
= 7,8 – 2x ومنه: x = 1,65 mol
ومنه:
n(O2) = 1,65 mol ، n(H2O) = 3,3 mol
ومنه تركيب المزيج عند t = 10 min يكون كما يلي:
|
H2O |
O2 |
H2O2 |
النوع |
|
3,3 |
1,65 |
4,5 |
كمية المادة (mol) |
جـ ـ سرعة إختفاء الماء الأكسجيني عند t = 10 min:
سرعة إختفاء الماء الأكسجيني عند t = 10 min تمثل القيمة المطلقة لميل المماس للبيان عند النقطة المقصودة.

ومنه:

ب ـ إيجاد كمية مادة
الوسيط:
من أجل v = 0,23 mol.min-1 و بالاعتماد على البيان نجد:
n(MnO2) =
2,6×10-4 mol
جـ ـ كلما زادت كمية مادة الوسيط زادت سرعة التفاعل.

تعليقات
إرسال تعليق