المقاربة الكمية لتفاعل كيميائي. الاجابة عن أهم الأسئلة
المقاربة الكمية لتفاعل كيميائي. الاجابة عن أهم الأسئلة
المقاربة الكمية لتفاعل كيميائي، هي دراسة تعتمد على التحليل الكمي لمواد التفاعل والنواتج، باستخدام القوانين الكيميائية. تهدف إلى حساب كميات المواد (المول، الكتلة، والحجم) بدقة، استنادًا إلى المعادلة الكيميائية المتوازنة، مما يُسهم في فهم العلاقات النسبية بين المواد المتفاعلة، والناتجة.
ملاحظة: توجد وثيقة التلميذ بصيغة الـ PDF في نهاية المقال.
I ـ الجملة الكيميائية:
1 ـ مفهوم الجملة الكيميائية:
هي خليط لعدة أنواع كيميائية، يمكن أن تتفاعل مع بعضها البعض في
شروط معينة من الضغط (P)، ودرجة الحرارة (T)، بكميات
معينة (n)، وبحالة فيزيائية ما قد تكون صلبة
(s) سائلة (l) غازية
(g).
2 ـ أمثلة عن جمل كيميائية متنوعة ووصفها:
ـ أذكر بعض الأمثلة عن الجمل الكيميائية ؟
الجمل الكيميائية التالية:
* خليط من الكبريت والحديد.
* حمض كلور الهيدروجين والحديد.
* محلول كبريتات النحاس والتوتياء.
* حمض الخل وهيدروجينوكاربونات الصوديوم.
II ـ تطور جملة كيميائية خلال تفاعل كيميائي
1 ـ تحقيق بعض
التحولات الكيميائية المختارة
أ/ خليط من الكبريت و الحديد
نأخذ كمية من برادة الحديد Fe قدرها 5,6 g ، ونخلطها مع 3,2 gمن الكبريت S، ثم نضع
المزيج فوق آجورة، في الشروط العادية من
الضغط ودرجة الحرارة.
ـ أحسب
عدد مولات كل من الحديد و الكبريت ؟
عدد مولات الحديد:
nFe = 5,6/56 = 0,1 mol
عدد مولات الكبريت:
nS = 3,2/32 = 0,1 mol
ـ ماذا نلاحظ بعد مزج برادة الحديد مع الكبريت ؟
لا نلاحظ حدوث أي شيء.
* الآن نستعمل مصباح بنزن
للحصول على شرارة لتسخين جزء من المزيج،
وعند ظهور الشرارة، نتوقف عن التسخين.
ـ ماذا
نلاحظ ؟
نلاحظ توهج المزيج في جميع
أجزائه، متحولا الى جسم صلب رمادي مسود.
ـ ماذا
يسمى المركب الناتج ؟
يسمى كبريت الحديد الثنائي FeS
ـ هل حدث تحول كيميائي ؟
نعم
حدث تحول كيميائي، لأننا
تحصلنا على جسم جديد يختلف عن الجسمين السابقين.
ـ أكتب معادلة التفاعل المنمذج للتحول الكيميائي؟
معادلة التفاعل المنمذج للتحول الكيميائي هي:
Fe(s)
+ S(s) → FeS(s)
ب/ حمض كلور الهيدروجين والحديد:
نضع في أنبوب إختبار قطع من الحديد بمقدار2g ، ونضيف 5cm3 من حمض كلور الهيدروجين، في الشروط العادية من الحرارة والضغط.
ـ ماذا
نلاحظ ؟
نلاحظ انطلاق فقاعات غازية تشكلت على مستوى قطع الحديد، كما نلاحظ إرتفاع درجة حرارة المحلول، مع تزايد تصاعد الفقاعات.
ـ ما هو الغاز الناتج و ماهي خصائصه ؟
الغاز الناتج هو ثنائي
الهيدروجين H2 ، ويتميز بأنه لا لون له ولا
رائحة، يشتعل بفرقعة بسيطة عندما نقرب إليه عود ثقاب.
ـ هل
يتشكل مركب آخر ؟
نعم يتشكل ملح كلور الحديد
الثنائي FeCl2.
ـ أكتب معادلة
التفاعل المنمذج للتحول الكيميائي؟
معادلة التفاعل المنمذج
للتحول الكيميائي هي:
Fe(s)
+ 2(H++ Cl-)(aq)→ H2 (g) + (Fe2++
2Cl-)(aq)
جـ/ محلول كبريتات النحاس والتوتياء:
نغمس صفيحة من الزنك Zn، في محلول كبريتات النحاس الثنائي (Cu2+(aq)+ SO42-(aq)) ذو اللون الأزرق، الذي
تركيزه المولي بشوارد النحاس [Cu2+] هو0,5 mol.L-1 .
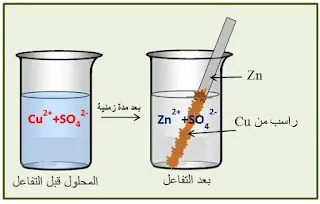
ـ ماذا
نلاحظ ؟
بعد فترة تغطى صفيحة الزنك
براسب ناعم أسود، ويختفي بعد مدة زمنية لون المحلول الأزرق، الناتج عن الشواردCu2+ التي كانت موجودة في المحلول، حيث حلت محلها
شوارد الزنك Zn2+ عديمة اللون، بينما ترسب
النحاس على الزنك.
ـ هل حدث
تحول كيميائي؟
نعم حدث تحول كيميائي، لأننا تحصلنا على أجسام
جديدة تختلف عن الاجسام السابقة
شوارد الزنك + معدن النحاس → معدن الزنك + شوارد النحاس
ـ أكتب معادلة التفاعل المنمذج للتحول الكيميائي؟
معادلة التفاعل المنمذج للتحول الكيميائي هي:
Zn(s) + (Cu2++ SO4 2-)(aq) → Cu(s) + (Zn2++
SO4 2-)(aq)
د/ حمض الخل و هيدروجينوكاربونات الصوديوم:
نأخذ قارورة بلاستيكية ثم نضع بداخلها 80 ml من الخل 6° ( CH3COOH )، نضع في بالونة مطاطية 5,04gمن هيدروجينوكاربونات الصوديوم الصلب، ونجعلها تسد فوهة القارورة.

ـ ماذا
نلاحظ ؟
نلاحظ انتفاخ البالون بغاز
هو ثنائي أكسيد الكربون، يمكن الكشف عنه بتعكيره لرائق الكلس، كما ينتج محلول خلات الصوديوم CH3COONa.
ـ ماذا
تستنتج ؟
نستنتج أنه حدث تحول كيميائي.
ـ أكتب معادلة التفاعل المنمذج للتحول الكيميائي؟
معادلة التفاعل المنمذج للتحول الكيميائي الحادث:
NaHCO3(s) + CH3COOH(aq)
= CH3COONa(aq) + CO2(g) + H2O(l)
الخلاصة:
ـ نسمي الأنواع الكيميائية الابتدائية
الداخلة في التحول: المتفاعلات.
ـ نسمي الأنواع الكيميائية التي تظهر في نهاية التحول: النواتج.
ـ ينمذج التحول الكيميائي (في الحالة العيانية) بعلاقة
تظهر تحول المتفاعلات إلى نواتج.
وهي معادلة التفاعل
الكيميائي:
النواتج → المتفاعلات
ـ هذه المعادلة الكيميائية
تحقق مبدأ إنحفاظ العناصر الكيميائية، ومبدأ
إنحفاظ الشحنة الكهربائية، بواسطة معاملات
توضع أمام المتفاعلات والنواتج تسمى المعاملات الستوكيومترية.
ـ ماهي
العوامل المؤثرة في التفاعل الكيميائي؟
يتأثر التفاعل الكيميائي بعدة عوامل منها:
* كمية المادة: التفاعلات لا تتم إلا بكميات محددة.
* درجة الحرارة: مثال تجربة تفاعل الحديد مع الكبريت.
* الضغط: بعض التفاعلات تتم في الضغط العادي، والبعض الآخر يحتاج
إلى شروط معينة من الضغط.
* الوسيط: وهو نوع كيميائي وجوده ضروري لحدوث التفاعل، رغم عدم
تدخله في التحول.
* الضوء: هناك بعض التفاعلات
الكيميائية لا تتم إلا في وجود الضوء. مثال: عملية التركيب الضوئي عند النباتات
الخضراء.
2 ـ نمذجة تحول كيميائي:
أ ـ وصف الحالة
الابتدائية والنهائية:
تجربة:
يحتوي وعاء 35 mol من الهواء (7 mol من O2 ، 28 mol من N2)، وعلى 5 mol من H2. عند الدرجة (T)، والضغط (P)، بإثارة الشرارة الكهربائية ثم التبريد، تظهر قطرات يمكن التعرف عليها بأنها الماء بالحالة السائلة، ونتابع تطور هذه الجملة:
ـ صف
الحالة الابتدائية للجملة الكيميائية ؟
نقصد بعبارة " الجملة في الحالة الابتدائية " قبل التحول،
تعرف حالة الجملة الكيميائية في هذه التجربة بأنواعها الكيميائية، وتمثل بالشكل
التالي:
|
الحالة الابتدائية (T ;P) 7 mol من O2 28 mol من N2 5 mol من H2 |
ـ صف الحالة النهائية للجملة الكيميائية ؟
|
الحالة النهائية (T’ ; P’) الأنواع الكيميائية الجديدة أو المتبقية |
التحول الكيميائي
نسمي مرور جملة كيميائية من حالة إبتدائية إلى حالة نهائية، تحولا كيميائيا.
|
الحالة النهائية (T’ ; P’) الأنواع الكيميائية الجديدة أو المتبقية |
|
الحالة الابتدائية (T ; P) 7 mol من O2 28 mol من N2 5 mol من H2 |
|
تحول كيميائي → |
||
|
|
هذا التحول يكون مصحوبا ببعض التغيرات الفيزيائية مثل
اللون، الضغط ... ، ويمكن الكشف عن النواتج ببعض الاختبارات التحليلية.
ب ـ
كتابة معادلة التفاعل الكيميائي المنمذجة للتحول الكيميائي:
ينمذج التحول الكيميائي الذي حدث بتفاعل
كيميائي، فيكون غازي ثنائي الهيدروجين، و ثنائي الأكسجين، هما المتفاعلات، وينتج بخار الماء الذي يتكاثف بالتبريد.
التفاعل الكيميائي يأخذ بعين الاعتبار التناسب بين المتفاعلات التي تختفي، وتعطي النواتج أثناء تطور الجملة، كتابته النموذجية تسمى المعادلة الكيميائية.
2H2(g) + O2(g) → 2H2O(ℓ)
هذه المعادلة تحقق قانون إنحفاظ العنصر والشحنة، وتستوجب تصحيح معاملات الرموز الكيميائية، (الموازنة الكيميائية)، وتسمى المعاملات الستوكيومترية.
III ـ مفهوم التقدم لتفاعل كيميائي خلال تحول كيميائي:
نشاط
يريد ميكانيكي أن يجهز عجلات
الدراجات بمحابس التثبيت، فوجد 12 محبس لتجهيز13 عجلة، تجهز كل عجلة بمحبسين،
وتكرر العملية x مرة، عدد العجلات 13، عدد المحابس 12
ـ أكمل الجدول التالي؟
|
|
x |
عدد العجلات الغير مجهزة |
عدد المحابس المتبقية |
عدد العجلات المجهزة |
|
الحالة الابتدائية |
0 |
13 |
12 |
0 |
|
|
1 |
13-1=12 |
12-2=10 |
1 |
|
|
2 |
13-2=11 |
12-2×2=8 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
الحالة النهائية |
|
|
|
|
اتمام الجدول:
|
|
x |
عدد العجلات الغير مجهزة |
عدد المحابس المتبقية |
عدد العجلات المجهزة |
|
الحالة الابتدائية |
0 |
13 |
12 |
0 |
|
|
1 |
13-1=12 |
12-2=10 |
1 |
|
|
2 |
13-2=11 |
12-2×2=8 |
2 |
|
|
3 |
13-3=10 |
12-2×3=6 |
3 |
|
|
4 |
13-4=9 |
12-2×4=4 |
4 |
|
|
5 |
13-5=8 |
12-2×5=2 |
5 |
|
الحالة النهائية |
6 |
13-6=7 |
12-2×6=0 |
6 |
ـ عبر عن الحالة النهائية ؟
نستطيع تحديد الحالة
النهائية بـ 6 عجلات مجهزة بالمحابس، و7
عجلات غير مجهزة.
ـ ما هو
سبب توقف عملية تجهيز عجلات الدراجات ؟
العملية توقفت بسبب نقص في
عدد المحابس.
ـ أكمل الجدول التالي؟
|
|
x |
عدد العجلات الغير مجهزة |
عدد المحابس المتبقية |
عدد العجلات المجهزة |
|
الحالة الابتدائية |
0 |
|
|
|
|
أثناء التحول |
x |
|
|
|
اتمام الجدول:
|
|
x |
عدد العجلات الغير مجهزة |
عدد المحابس المتبقية |
عدد العجلات المجهزة |
|
الحالة الابتدائية |
0 |
13 |
12 |
0 |
|
أثناء التحول |
x |
13-x |
12-2x |
x |
ـ ماذا نسمي x ؟
نسمي
x التقدم.
ـ أوجد قيمة x1 (عدد العمليات) اللازمة لتجهيز كل العجلات ؟
إذا إنعدم عدد العجلات الغير مجهزة نجد: 13 – x1 = 0 ومنه: x1 = 13
ـ أوجد قيمة x2 (عدد العمليات) اللازمة لاستعمال كل المحابس؟
إذا إنعدم عدد المحابس المتبقية نجد: 12 – 2x2 = 0 ومنه: x2 = 6
- ما هي قيمة x التي من أجلها ينتهي أحد المتفاعلات دون أن ينتهي الاخر؟
القيمة هي x2 = 6
ـ ماذا نسمي المتفاعل الذي ينتهي؟
نسمي المتفاعل الذي ينتهي، المتفاعل المحد.
ـ ما هي قيمة التقدم الأعظمي؟
قيمة التقدم الأعظمي هي xmax = x2 = 6
ـ أكمل الجدول التالي؟
|
|
التقدم x |
عدد العجلات الغير مجهزة |
عدد المحابس المتبقية |
عدد العجلات المجهزة |
|
الحالة الابتدائية |
0 |
|
|
|
|
أثناء التحول |
x |
|
|
|
|
الحالة النهائية |
xmax |
|
|
|
اتمام الجدول:
|
|
التقدم x |
عدد العجلات الغير مجهزة |
عدد المحابس المتبقية |
عدد العجلات المجهزة |
|
الحالة الابتدائية |
0 |
13 |
12 |
0 |
|
أثناء التحول |
x |
13-x |
12-2x |
x |
|
الحالة النهائية |
xmax |
7 |
0 |
6 |
ـ مثل تغيرات كل من عدد العجلات
الغير مجهزة، عدد المحابس المتبقية، عدد العجلات المجهزة بدلالة x ؟
نعيد
التجربة بمعطيات جديدة (عدد العجلات 6، عدد المحابس 12) نتحصل على الجدول التالي:
ـ أكمل الجدول التالي ؟
|
|
التقدم x |
عدد العجلات الغير مجهزة |
عدد المحابس المتبقية |
عدد العجلات المجهزة |
|
الحالة الابتدائية |
0 |
6 |
12 |
0 |
|
|
1 |
6-1=5 |
12-2=10 |
1 |
|
|
2 |
6-2=4 |
12-2×2=8 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
الحالة النهائية |
|
|
|
|
اتمام الجدول:
|
|
التقدم x |
عدد العجلات الغير مجهزة |
عدد المحابس المتبقية |
عدد العجلات المجهزة |
|
الحالة الابتدائية |
0 |
6 |
12 |
0 |
|
|
1 |
6-1=5 |
12-2=10 |
1 |
|
|
2 |
6-2=4 |
12-2×2=8 |
2 |
|
|
3 |
6-3=3 |
12-2×3=6 |
3 |
|
|
4 |
6-4=2 |
12-2×4=4 |
4 |
|
|
5 |
6-5=1 |
12-2×5=2 |
5 |
|
الحالة النهائية |
6 |
6-6=0 |
12-2×6=0 |
6 |
ـ أكمل الجدول التالي؟
|
|
التقدم x |
عدد العجلات الغير مجهزة |
عدد المحابس المتبقية |
عدد العجلات المجهزة |
|
الحالة الابتدائية |
0 |
|
|
|
|
أثناء التحول |
x |
|
|
|
|
الحالة النهائية |
xmax |
|
|
|
اتمام الجدول:
|
|
التقدم x |
عدد العجلات الغير مجهزة |
عدد المحابس المتبقية |
عدد العجلات المجهزة |
|
الحالة الابتدائية |
0 |
6 |
12 |
0 |
|
أثناء التحول |
x |
6-x |
12-2x |
x |
|
الحالة النهائية |
xmax |
0 |
0 |
6 |
ـ مثل تغيرات كل من عدد العجلات الغير مجهزة، عدد المحابس المتبقية، عدد العجلات المجهزة بدلالة x ؟
تمثيل تغيرات كل من عدد العجلات الغير مجهزة، عدد المحابس المتبقية، عدد العجلات المجهزة بدلالة x .ـ هل جهزت
كل العجلات بمحابس؟
نعم جهزت كل العجلات بمحابس، ولم يبقى شيء من المتفاعلات.
ـ ماذا نقول عن الشروط التي تحققت فيها العملية ؟
نقول أن العملية تحققت في الشروط الستوكيومترية.
نتيجة:
من أجل متابعة تحول كيميائي لجملة على المستوى العياني، من الحالة الابتدائية إلى الحالة النهائية، يقترح الاتحاد الدولي للكيمياء البحتة، والتطبيقية. وسيلة تدعى تقدم التفاعل.
يعبر عن تطور الجملة أثناء التحول الكيميائي بالتقدم، ويتوقف هذا التحول عندما يختفي أحد المتفاعلات، ويسمى في هذه الحالة المتفاعل المختفي بالمتفاعل المحد.
* وحدة التقدم: يعبر عن التقدم بالمول، وهي وحدة كمية المادة.
* جدول التقدم: عبارة عن جدول وصفي للجملة، يوضح حصيلة المادة خلال تحول كيميائي، من الحالة الابتدائية إلى الحالة النهائية.
وثيقة التلميذ بصيغة الـ PDF





مشكور جزيل الشكر أستاذ والله يوفقك في مسيرتك المهنية
ردحذف