حلول تمارين الكتاب المدرسي حول قياس الناقلية
حلول تمارين الكتاب المدرسي حول قياس الناقلية
حلول تمارين قياس الناقلية دليلاً عمليًا لفهم المفاهيم النظرية والتطبيقية، مثل كيفية استخدام الأجهزة لقياس الناقلية، وحساب الناقلية المولية، والناقلية النوعية، وتحليل تأثير العوامل المختلفة كدرجة الحرارة، وتركيز المحلول على الناقلية.
قياس الناقلية هو موضوع مهم في الكيمياء الكهربائية، ويُعنى بدراسة قدرة المواد على توصيل التيار الكهربائي، سواء كانت محاليل شاردية، أو مواد صلبة. يساعد هذا الدرس على فهم العلاقة بين تركيز الأيونات الناقلة، والكهربائية في المحلول.
حل التمرين الأول صفحة 280
1 ـ خطأ،
التصحيح (التيار الكهربائي في المعادن ناتج عن حركة الالكترونات الحرة، بينما في
المحاليل فهو ناتج عن حركة الشوارد الموجبة نحو المهبط، والسالبة نحو المصعد)
2 ـ صحيح
3 ـ صحيح
4 ـ خطأ، التصحيح (تتعلق الناقلية النوعية σ لمحلول كيميائي بنوع الشوارد Xi في المحلول، وتركيزها [Xi] ، ونكتبها σ = λ1[X1] + λ2[X2] + λ3[X3] + λ4[X4] + … حيث λi هي الناقلية النوعية المولية الشاردية للشاردة Xi
5
ـ خطأ، التصحيح (λi مقدار ثابت يخص شاردة Xi في درجة حرارة معينة، وليس له علاقة بأبعاد
الخلية المستعملة في القياس.
6
ـ خطأ، التصحيح (يسمى المقدار S/L ثابت الخلية المستعملة في قياس الناقلية).
7 ـ صحيح
حل التمرين الثاني صفحة 280
1 ـ ثابت الخلية k يتغير اذا تغير سطح اللبوسين، أو البعد بينهما.
2 ـ أ)
صحيح ، ج) صحيح.
العبارات الصحيحة والخاطئة:
ـ خلية القياس تتكون من مصعد ومهبط معدنيين (صحيحة).
ـ الناقلية هي مقلوب المقاومة، وحدتها Siemens (تصحيح).
ـ ليس للشوارد ذات الشحنة (+1) نفس الناقلية
النوعية المولية الشاردية (تصحيح).
حل التمرين الثالث صفحة 280
حساب الناقلية النوعية:
بالنسبة لكلور
البوتاسيوم
لدينا: KCl
→ K+ + Cl-
ومنه: [KCl] = [K+] = [Cl-] = C = 35,2 mol/m3
ولدينا: σ
= λK+[K+] + λCl-[Cl-] = C(λK+
+ λCl-)
ومنه: σ
= 35,2 (7,35 + 7,63)×10-3 = 0,527 S.m-1
بالنسبة لهيدروكسيد
الكالسيوم
لدينا: Ca(OH)2
→ Ca2+ + 2OH-
ومنه: [Ca(OH)2] = [Ca2+] = C = 26,8 mol/m3
[OH -] = 2C
ولدينا:
σ
= λCa2+ [Ca2+]
+ λ OH-[OH -] = C(λ Ca2+ +
2λ OH-)
ومنه: σ = 26,8 (11,9 + 2×19,9)×10-3 = 1,385 S.m-1
حل التمرين الرابع صفحة 281
1 ـ حساب ثابت الخلية k:
K = S/L = 1×10-4/1,5×10-2
= 0,67×10-2 m
2 ـ حساب الناقلية النوعية σ
للمحلول:
حل التمرين السادس صفحة 281
1 ـ حساب التركيز المولي لمحلول يود الصوديوم NaI:
لدينا: [NaI] = C = Cm/M حيث Cm: التركيز الكتلي، M: الكتلة المولية الجزيئية
لدينا: M
= 23 + 127 = 150 g/mol
ومنه: C
= 2/150 = 13,3×10-3 mol.L-1
2 ـ حساب الناقلية النوعية للمحلول:
لدينا: NaI
→ Na+ + I-
ومنه: [NaI] = [Na+] = [I-] = C = 13,3 mol/m3
ولدينا: σ
= λNa+.[Na+] + λI-.[I-] = C(λNa+
+ λI-)
ومنه: σ
= 13,3(5,01 + 7,70)×10-3 = 0,169 S.m-1
حل التمرين السابع صفحة 281
1 ـ إثبات أنه يمكن حساب ناقلية محلول نترات
الصوديوم:
لدينا بالنسبة للمحلول (S1):
NaCl
→ Na+ + Cl-
ومنه: [NaCl] = [Na+] = [Cl-] = C
ومنه: G1
= k.σ1 = k(λNa+.[Na+] + λCl-.[Cl-])
= k.C(λNa+ + λCl-)
ولدينا بالنسبة للمحلول (S2):
KCl
→ K+ + Cl-
ومنه: [KCl] = [K+] = [Cl-] = C
ومنه: G2
= k.σ2 = k(λK+.[ K+] + λCl-.[Cl-])
= k.C(λK+ + λCl-)
ولدينا بالنسبة للمحلول (S3):
KNO3
→ K+ + NO3-
ومنه: [KNO3] = [K+] = [NO3-]
= C
ومنه:
G3
= k.σ3 = k(λK+.[K+] + λNO3-.[NO3-])
= k.C(λK+ + λ NO3-)
ولدينا بالنسبة للمحلول (S):
NaNO3
→ Na+ + NO3-
ومنه: [NaNO3] = [Na+] = [NO3-]
= C
ومنه:
G
= k.σ = k(λNa+.[Na+] + λNO3-.[NO3-])
= k.C(λNa+ + λ NO3-)
يمكن أن نكتب:
G = k.C(λNa+ + λ Cl-)
- k.C(λK+ + λCl-) + k.C(λK+ + λ NO3-)
ومنه
نجد: G
= G1 – G2 + G3
2
ـ حساب G(Na+
+ NO3-):
G
= 1,16 – 1,37 + 1,33 = 1,12 mS
3 ـ المحلول الذي له نقل
كهربائي أكبر هو محلول كلور البوتاسيوم.
حل التمرين الثامن صفحة 281
1 ـ التعبير عن G بدلالة S ، L ، C ، λ :
بالنسبة
لمحلول (Na+ + OH-):
G1
= k.σ1 = k(λNa+.[Na+] + λOH-.[OH
-]) = k.C(λNa+ + λOH-) حيث : k =S/L
بالنسبة
لمحلول (Na+ + Cl-):
G2
= k.σ2 = k(λNa+.[Na+] + λCl-.[Cl-])
= k.C(λNa+ + λCl-)
بالنسبة
لمحلول (K+ + Cl-):
G3
= k.σ3 = k(λK+.[ K+] + λCl-.[Cl-])
= k.C(λK+ + λCl-)
2
ـ إثبات أنه يمكن قياس ناقلية محلول هيدروكسيد
البوتاسيوم :
بالنسبة
لمحلول (K+ + OH-):
G
= k.σ = k(λK+.[K+] + λOH-.[OH -]) =
k.C(λK+ + λOH-)
يمكن أن نكتب:
G
= k.C(λK+ + λCl-) + k.C(λNa+ + λOH-)
- k.C(λNa+ + λCl-)
ومنه
نجد: G
= G3 + G1 – G2
تطبيق
عددي:
G
= 1,85 + 3,19 – 1,56 = 3,48 mS
حل التمرين التاسع صفحة 282
1 ـ رسم البيان G = f(C):
3
ـ بالاعتماد على البيان نجد: C = 4,8 mmol.L-1
حل التمرين العاشر صفحة 282
1 ـ معادلة انحلال KNO3 في الماء:
KNO3
→ K+ + NO3-
2 ـ كيفية حساب تركيز
نترات البوتاسيوم:
نقيس ناقلية هذا المحلول باستعمال نفس الخلية، ثم
نستعمل بيان المعايرة، ونستنتج منه التركيز المولى الموافق لقيمة الناقلية المقاسة.
3 ـ رسم البيان G = f(C):
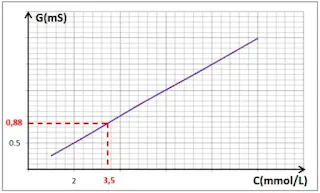
4 ـ حساب التركيز المولي للمحلول:

لدينا: G = Ieff/Ueff
= 0,88/1 = 0,88 mS
و
بالاعتماد على البيان نجد: C = 3,5 mmol.L-1
حل التمرين 11 صفحة 282
1 ـ معادلة انحلال كبريتات الصوديوم في الماء هي:
Na2SO4
→ 2Na+ + SO42-
2 ـ مخطط تركيب الدارة المستعملة في التجربة:
|
S6 |
S5 |
S4 |
S3 |
S2 |
S1 |
|
|
C6 |
0,5 |
1,0 |
5,0 |
7,5 |
10,0 |
C(mmol/L) |
|
0,808 |
0,851 |
0,851 |
0,851 |
0,850 |
0,904 |
U(V) |
|
0,700 |
0,125 |
0,212 |
1,010 |
1,485 |
2,070 |
I(mA) |
|
0,866 |
0,147 |
0,249 |
1,187 |
1,747 |
2,290 |
G(mS) |
4 ـ رسم البيان G = f(C):

نلاحظ أن البيان عبارة عن خط مستقيم، ومنه الناقلية تتناسب مع التركيز المولي.
5 ـ التراكيز المولية للشوارد في المحلول S6:
بالاعتماد
على البيان نجد: C6 = 3,7 mmol.L-1
وبالاعتماد
على معادلة الانحلال نجد:
[Na2SO4] = [SO42-] =
3,7 mmol.L-1

تعليقات
إرسال تعليق