عمل مخبري حول سرعة التحولات الكيميائية
عمل مخبري حول سرعة التحولات الكيميائية
ملاحظة: توجد وثيقة التلميذ بصيغة الـ PDF في نهاية المقال
الموضوع: المدة المستغرقة في تحول جملة كيميائية
بواسطة العين أو بواسطة طريقة قياس معينة، يمكن ملاحظة تشكل أو اختفاء نوع كيميائي معین خلال تحول كيميائي بين حالته الابتدائية و النهائية.
ـ هل التحول الكيميائي يحدث أنيا أو يستغرق مدة
زمنية ؟
المحاليل و الوسائل المستعملة:
- محلول حمض الأوكساليك (0,5
mol/L)
- محلول موهر (1,0×10-2mol/L)
(mohr)
- محلول برمنغنات البوتاسيوم (1,0×10-3mol/L)
- محلول ثيوكبريتات الصوديوم (0,2 mol/L)
- محلول يود البوتاسيوم (1,0×10-2mol/L)
- محلول نترات الرصاص (0,1
mol/L
- محلول حمض الكبريت (1
mol/L
- مخبارين مدرجين (50
mL)
- مخبار مدرج (10
mL)
- مخلاط مغناطیسي
ـ أنابيب إختبار.
- كأسي بيشر (100
mL)
التجربة 1:
نسكب في كــــأس بيشر 20 mL من محلول موهر (محلول يحتوي على شوارد الحديد الثنائي Fe2+(aq)) و 5 mL من حمض الكبريت (2H+ + SO42-)(aq) ، نخلط الوسط التفاعلي بواسطة المخلاط المغناطيسي حتى نحصل على محلول
متجانس ثم نضيف له دفعة واحدة
5 mL من برمنغنات البوتاسيوم (K+
+ MnO4-)(aq)
الثنائيتان المشاركتان
في التفاعل هما: (MnO4-(aq)/Mn2+(aq)) ، (Fe3+(aq)/Fe2+(aq))
1- أنجز باستعمال
الألوان رسما توضيحيا ؟
2- هل التحول الحادث
سريع أم بطيء ؟
3- بين كيف يمكن متابعة
التحول الحادث ؟
4- أكتب معادلة التفاعل
الكيميائي المنمذج لكل تحول حادث ؟
الاجابة:
1 ـ انجاز رسما توضيحيا باستعمال الألوان:
2 - هل التحول الحادث سریع أم بطيء ؟
يكون إختفاء اللون البنفسجي لمحلول برمنغنات البوتاسيوم لحظيا أي لحظة تلامس محلول برمنغنات البوتاسيوم و محلول موهر إذا التحول الحادث هو تحول سريع.
3 ـ تتم متابعة هذا التحول بمتابعة
اختفاء شاردة البرمنغنات MnO4-(aq) البنفسجية اللون من الوسط التفاعلي.
4- كتابة معادلة التفاعل المنمذج
للتحول الحادث:
المعادلة النصفية الإلكترونية
للأكسدة:
5(Fe2+(aq)
→ Fe3+(aq)+1e-)
* المعادلة النصفية
الإلكترونية للإرجاع:
MnO4-(aq) +
8H+(aq) + 5e- → Mn2+(aq)
+ 4H2O(ℓ)
* معادلة الأكسدة –
ارجاع:
MnO4-(aq) + 5 Fe2+(aq) + 8H+(aq)
→ Mn2+(aq) + 5Fe3+
(aq) + 4H2O(ℓ)
التجربة 2:
نسكب في كأس بيشر 20 mL من حمض الأوكساليك (H2C2O4)(aq) و 5 mL من حمض الكبريت (2H+ + SO42-)(aq) ، نخلط المزيج بواسطة المخلاط المغناطيسي، ثم نضيف له دفعة واحدة 5 mL من برمنغنات البوتاسيوم (K+
+ MnO4-)(aq)
الثنائيتان المشاركتان
في التفاعل هما: (MnO4-(aq)/Mn2+(aq)) ، (CO2(g)/H2C2O4(aq))
1- أنجز باستعمال
الألوان رسما توضيحيا ؟
2- هل التحول الحادث
سريع أم بطيء ؟
3- بين كيف يمكن متابعة
التحول الحادث ؟
4- أكتب معادلة التفاعل
الكيميائي المنمذج لكل تحول حادث ؟
الاجابة:
1 ـ انجاز رسما توضيحيا باستعمال الألوان:
2 - هل التحول الحادث سريع أم بطئ؟
نلاحظ إختفاء اللون البنفسجي (العائد لشاردة MnO4-(aq) ) لمحلول برمنغنات البوتاسيوم تدريجيا مع مرور الزمن إذا التحول الحادث هو تحول بطيء
3- تتم متابعة هذا التحول بمتابعة اختفاء شاردة البرمنغنات MnO4-(aq) البنفسجية اللون من الوسط التفاعلي.
4 - كتابة معادلة التفاعل المنمذج
للتحول الحادث:
المعادلة النصفية
الإلكترونية للأكسدة:
5(H2C2O4(aq)
= 2CO2(g) + 2H+(aq) + 2e-)
المعادلة النصفية
الإلكترونية للإرجاع:
2(MnO4-(aq) + 8H+(aq)
+ 5e- → Mn2+(aq) + 4H2O(ℓ))
معادلة الأكسدة - ارجاع:
2MnO4-(aq) + 5 H2C2O4(aq) + 6H+(aq) → 2Mn2+(aq)
+ 10 CO2(g) + 8H2O(ℓ)
التجربة 3:
نضع في أنبوب إختبار 2 mL من محلول يود البوتاسيوم (K+
+ I-)(aq) ثم نضيف له 2 mL من محلول نترات الرصاص (Pb2+ + 2NO3-)(aq)
1- أنجز باستعمال
الألوان رسما توضيحيا ؟
2- هل التحول الحادث
سريع أم بطيء ؟
3- بين كيف يمكن متابعة
التحول الحادث ؟
4- أكتب معادلة التفاعل
الكيميائي المنمذج لكل تحول حادث ؟
الاجابة:
1 ـ انجاز رسما توضيحيا باستعمال الألوان:
2- هل التحول الحادث سریع أم بطئ؟
- نلاحظ تشكل راسب أصفر فاتح لحظة تلامس المحلولين إذن التحول الحادث هو تحول سريع.
3- تتم متابعة هذا
التحول بمتابعة ظهور نوع كيميائي (راسب أصفر).
4- كتابة معادلة التفاعل المنمذج
للتحول الحادث:
2(K+ + I-)(aq)
+ (Pb2+ + 2NO3-)(aq) = PbI2(s)
+ 2(K+ + NO3-)(aq)
التجربة 4:
نسكب في كأس بيشر 10 mL من محلول ثيوكبريتات الصوديوم (2Na+ + S2O32-)(aq) و 10 mL من محلول حمض كلور الهيدروجين (H+ + Cℓ-)(aq)
الثنائيتان المشاركتان
في التفاعل هما: (S2O32-(aq)/S(s)) ، (SO2(g)/S2O32-(aq))
1- أنجز باستعمال الألوان رسما
توضيحيا ؟
2- هل التحول الحادث
سريع أم بطيء ؟
3- بين كيف يمكن متابعة
التحول الحادث ؟
4- أكتب معادلة التفاعل
الكيميائي المنمذج لكل تحول حادث ؟
الاجابة:
1 ـ انجاز رسما توضيحيا باستعمال الألوان:
2 - هل التحول الحادث سريع أم بطيء؟
- نلاحظ أن المزيج المتفاعل يتلون تدريجيا بمرور الزمن بلون مصفر وحليبي .إن هذا اللون
يعود إلى تشكل الكبريت الصلب S(s) الذي يبقى عالقا بالمزيج. إذن هذا التحول هو تحول بطيء .
3- تتم متابعة هذا التحول بمتابعة تشكل الكبريت الصلب S(s)
4- أكتب معادلة التفاعل المنمذج
للتحول الحادث:
- المعادلة النصفية
الإلكترونية للأكسدة:
S2O32-(aq)
+ H2O(ℓ) = 2SO2(g) + 2H+(aq)
+ 4e-
ـ المعادلة النصفية
الإلكترونية للإرجاع:
S2O32-(aq)
+ 6H+ (aq) +4e- = 2S(s) + 3H2O(ℓ)
- المعادلة الأكسدة –
ارجاع:
S2O32-(aq)
+ 2H+ (aq) = S(s) + SO2(g) + H2O(ℓ)
خلاصة:
من خلال التجارب
السابقة:
1- صنف التفاعلات
السابقة إلى سريعة و بطيئة ملخصة في جدول؟
2- متى نقول عن تحول
كيميائي أنه سريع و متى نقول عنه أنه بطيء؟
الاجابة:
1- تصنيف التفاعلات
السابقة إلى سريعة و بطيئة ملخصة في جدول:
|
التجربة |
(1) |
(2) |
(3) |
(4) |
|
تفاعل سريع |
x |
|
x |
|
|
تفاعل بطيء |
|
x |
|
x |
2- نقول عن تحول كيميائي أنه سريع
إذا كان ظهور أو اختفاء نوع كيميائي لحظة تلامس المتفاعلات.
- نقول عن تحول كيميائي أنه بطيء إذا كان ظهور أو اختفاء نوع كيميائي تدريجيا، أي بعد مرور مدة زمنية على تلامس المتفاعلات.
وثيقة التلميذ بصيغة الـ PDF

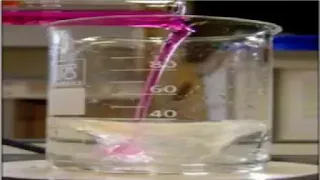






تعليقات
إرسال تعليق