الطاقة الداخلية. 2/2
الطاقة الداخلية. 2/2
في هذا الجزء الثاني من سلسلة "الطاقة الداخلية"، نستكمل الإجابة عن أهم الأسئلة المتعلقة بهذا المفهوم الفيزيائي الأساسي. سنتناول مواضيع مثل عوامل تأثير الطاقة الداخلية، كيفية حسابها، ودورها في الأنظمة الديناميكية الحرارية. بالإضافة إلى ذلك، نوضح الفرق بين الطاقة الداخلية والطاقة الحرارية، مع أمثلة تطبيقية لتبسيط الفهم. إذا كنت تبحث عن شرح شامل ومفصل عن الطاقة الداخلية، فهذا المقال هو دليلك الأمثل لتحصيل المعلومات بشكل واضح ودقيق.
6 ـ مركبة الطاقة الداخلية المنسوبة إلى الحالة الفيزيائية- الكيميائية لجملة:
6 ـ 1 ـ طاقة التماسك (التحول الفيزيائي):
نشاط ـ 1 ـ
خذ قطعة من جليد وضعها داخل وعاء معدني، فيه كمية من ماء بارد درجة حرارته تقارب θ = 0°C
راقب لمدة كافية باستعمال محرار درجة حرارة الجملة، (كمية الماء قطعة الجليد والوعاء).
1 ـ هل الجملة معزولة حراريا ؟
الجملة ليست معزولة حراريا
2 ـ قس باستعمال ميقاتيه مدة ذوبان الجليد ؟
3 ـ هل درجة حرارة الجملة تغيرت مدة ذوبان الجليد ؟
لا درجة حرارة الجملة لم تغير مدة ذوبان الجليد، وبقيت ثابتة θ = 0°C
4 ـ هل الجملة اكتسبت طاقة من الوسط الخارجي مدة ذوبان الجليد ؟
نعم الجملة اكتسبت طاقة من الوسط الخارجي مدة ذوبان الجليد
5 ـ إذا كان الجواب نعم، ما هو أثر الطاقة المكتسبة على الجملة ؟
يظهر أثر الطاقة المكتسبة من طرف الجملة، في التحول الفيزيائي للماء من حالة صلبة إلى حالة سائلة، حيث تصبح الجزيئات ضعيفة الارتباط، وبالتالي تزداد الطاقة الحركية المجهرية لها.
نتيجة:
تمتص قطعة الجليد تحويلا حراريا، من الوسط الخارجي، حتى تتحول من قطعة الجليد عند درجة حرارة 0°C، الى ماء سائل عند نفس درجة الحرارة.
نشاط ـ 2 ـ
أعد التجربة السابقة بأخذ كتل مختلفة للجليد (2m , 3m , 4m ...)
1 ـ قس مدة ذوبان الجليد.
تزداد مدة ذوبان الجليد بزيادة الكتلة.
2 ـ قارن هذه المدة مع مدة ذوبان الجليد في تجربة النشاط -1- ماذا تستنتج؟
المدة الزمنية لذوبان الجليد، أكبر من المدة الزمنية في النشاط -1-. نستنتج أن الكتلة تتناسب طردا مع مدة التحويل الحراري، وبالتالي مع قيمة التحويل الحراري.
3 ـ في رأيك هل قيمة التحويل الحراري في النشاط اكبر من قيمة التحويل في النشاط -1- لماذا ؟
قيمة التحويل الحراري في هذا النشاط، أكبر من قيمة التحويل في النشاط -1- ، لان التحويل الحراري يتناسب طردا مع كتلة المادة المستقبلة.
نتيجة:
تتناسب
مدة الذوبان مع كتلة قطعة الجليد، بما أن التحويل الحراري المتبادل بين الجليد، والوسط الخارجي متناسب مع الزمن، نستنتج أن قيمة التحويل الحراري، اللازم لذوبان قطعة الجليد متناسب مع كتلته. يمثل التحويل الحراري المرافق لذوبان قطعة الجليد، الطاقة اللازمة لتلاشي الروابط التي كانت تتماسك بها جزيئات الماء. تـدعـى هذه الطاقة طــاقـة الـتماسك.
عبارة التحويل الحراري Q في حالة تغير الحالة الفيزيائية للمادة:
يتطلب تغير الحالة الفيزيائية لجسم نقي كتلته m عند درجة حرارة ثابتة، تحويلا حراريا Q عبارته: Q = m L
حيث Q: التحويل الحراري بالجول (J) , m : كتلة الجسم بالكيلوغرام kg .
L : السعة الكتلية لتغير الحالة (J/kg)، وتتعلق بنوع المادة، وتغيرات الحالة الفيزيائية (انصهار أو تبخر).
التحويلا ت الحرارية لتغير الحالة الفيزيائية للمادة:
ـ الانصهار:
تحول ماص للحرارة (اكتساب طاقة)
Qf = m Lf
ـ التجمد:
تحول ناشر للحرارة (فقد طاقة)
Qs = - Qf = - m Lf
ـ التبخر:
تحول ماص للحرارة (اكتساب طاقة)
Qv = m Lv
ـ التمييع:
تحول ناشر للحرارة. (فقد طاقة)
Ql = - Qv = -m Lv
التفسير المجهري لتغير الحالة الحرارية المرافقة لتحويل فيزيائي:
في الغازات يزداد اضطراب الجزيئات مع تزايد درجة الحرارة، فالحرارة
التي تقدم للغاز لجعل درجة حرارته ترتفع، تساهم في ازدياد سرعة الجزيئات التي تشكل
الغاز، وبالتالي ازدياد في الطاقة الحركية الميكروسكوبية. عكس هذا عندما تنخفض
درجة حرارة الغاز، فان هذا الأخير يمد الوسط الخارجي طاقة، على شكل حرارة لان سرعة
جزيئاته تتناقص. في السوائل رغم أن الجزيئات تكون متراصة مع بعضها البعض، إلا أنها
تتحرك وتهيم في كل الاتجاهات، وتتزايد هذه الحركة مع تزايد درجة الحرارة. أما في
الأجسام الصلبة الأفراد المكونة لهذا الجسم، تشغل مواقع محددة ولكنها تهتز حول هذه
المواقع . كلما ارتفعت درجة الحرارة كلما زادة حدة هذه الاهتزازات.
تطبيق:
تحديد السعة الكتلية لانصهار الجليد :Lf
طريقة العمل:
ـ نضع قطع من الجليد كتلتها M في إناء يحتوي على ماء مقطر، وننتظر التوازن الحراري، ثم نقيس بالمحرار درجة الحرارة لتوازن الجملة (ماء + جليد)، ونتأكد أنها θ = 0°C
ـ خلال هذه الفترة نضع كمية من ماء كتلتها m في المسعر، وننتظر التوازن الحراري، ثم نقيس درجة الحرارة الابتدائية Ti للماء والمسعر.
ـ نأخذ من الإناء قطع جليدية (قطعة أوقطعتين حسب الحجم) ونقوم بمسحها بسرعة بمنديل ورقي و نضعها في المسعر نراقب بواسطة المحرار انخفاض درجة الحرارة الناتج عن ذوبان القطع الجليدية.
ـ ننتظر التوازن الحراري و نقيس درجة الحرارة النهائية Tf للجملة.
ـ حدد الجملة المدروسة ؟
الجملة المدروسة هي (المسعر + الماء + القطع الجليدية).
ـ حدد الحالتين الابتدائية والنهائية ؟
الحالة الابتدائية | المسعر : درجة حرارته Ti |
الماء : كتلته m ودرجة حرارته Ti | |
القطعة الجليدية : كتلتهاM ودرجة حرارتها 0 | |
الحالة النهائية | المسعر : درجة حرارته Tf |
الماء : كتلته m ودرجة حرارته Tf | |
القطعة الجليدية التي تحولت الى كمية ماء :درجة حرارتها Tf |
ـ حدد التحويلات الحرارية الحادثة ؟
الاجابة:
المسعر الحراري: فقد تحويلا حراريا Q1 وانخفضت درجة حرارته من Ti إلىTf : Q1 = C(Tf – Ti)
الماء: فقد تحويلا حراريا Q2 وانخفضت درجة حرارته من Ti إلىTf :
Q2 = m.c(Tf – Ti)
القطع الجليدية: استقبلت تحويلا حراريا على مرحلتين :
المرحلة الأولى:
تحولت حالتها عند درجة حرارة ثابتة T = 0°C من حالة صلبة إلى حالة سائلة، حيث استقبلت تحويل حراري:
Q3 = M.L
المرحلة الثانية:
استقبلت تحويلا حراريا Q4 وارتفعت درجة حرارتها من Ti = 0°C إلى : Tf
Q4 = M.c(Tf – Ti)
ـ عبر عن الحصيلة الحرارية للجملة ؟
بما أن الجملة شبه معزولة فإن :
Q1 + Q2 + Q3 + Q4 = 0
ـ استنتج عبارة السعة الكتلية لانصهار الجليد Lf؟
مما سبق نجد:
C(Tf – Ti) + m.c(Tf –Ti) + M.L + M.c(Tf – 0) = 0
نستخلص أن:
وهي العلاقة التي تعطي قيمة السعة الكتلية لانصهار الجليد.
يمكن مقارنة القيمة التي تتحصل عليها مع القيمة الجاري العمل بها:
Lf = 335 kJ/kg
6 ـ 2 ـ طاقة الرابطة الكيميائية:
(تعيين طاقة الربط الكيميائية لوقود قداحة).
1 ـ ضع كتلة m = 50 g من ماء في علبة من الألمنيوم.
2 ـ خذ
قداحة تحتوي على كمية من وقود(مادة البوتان C4H10)، وعلم المستوى الابتدائي ni للوقود الموجود داخلها. استعمل هذه القداحة لتسخين الكمية السابقة
من الماء.
3 ـ استعمل محرار لقياس درجة الحرارة الابتدائية θi للماء قبل التسخين، ودرجة الحرارة النهائية θƒبعد التسخين، (مدة التسخين حوالي دقيقة).
التغير في درجة الحرارة خلال مدة التسخين Δθ = 15°C
4 ـ عين على القداحة المستوى النهائي nƒ للوقود.
5 ـ قدر كمية الوقود لتسخين الماء، (يمكن
معايرة خزان القداحة).
كمية الوقود لتسخين الماء m = 150 mg
6 ـ لماذا تستعمل وعاء من الألمونيوم ؟
نستعمل وعاء من الألمنيوم لتسهيل انتقال الحرارة من القداحة إلى الماء وخفض الضياع الطاقوي
7 ـ مثل الحصيلة
الطاقوية للجملة (ماء) بين بداية التسخين ونهايته.
الاجابة:
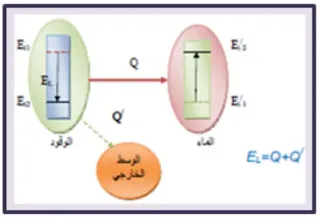
8 ـ أحسب الطاقة المكتسبة من الماء علما أن السعة الكتلية للماء تساوي c = 4,185 (j/g.k).
m = 50 g ، ΔQ = 15°C
ومنه:
Q = m.c(θf – θi) = 50.4,185.15 = 3138,75 J
9 ـ استنتج الطاقة EL التي تحرر
عن احتراق كتلة m = 1g من الوقود علما أن الكتلة الحجمية لوقود القداحة.
ρ = 0.58 g.cm-3
لدينا: EL = Q + Q' بإهمال الطاقة غير المفيدة Q' اذا EL = Q = 2500 J
عند معايرة القداحة نجد ان الوقود المستهلك هو V = 0,26 cm3
كتلة الوقود المستهلك هي: m = ρ.V = 0,58.0,26 = 0,15 g
والطاقة المحررة لهذا الكمية هي: EL = 2500 J
m = 0,15g الوقود ← 3138,75 J
m = 1g الوقود ← EL
ومنه:
طاقة الرابطة المحررة لاحتراق 1g من الوقود: EL ≈ 20925 J/g
10 ـ الطاقة المكتسبة من الماء أقل من الطاقة المحررة من احتراق الوقود، أي أن قيمة طاقة الرابطة الكيميائية Eℓ التي وجدتها في التجربة أقل من القيمة الحقيقية. لماذا ؟
الطاقة المكتسبة من الماء اقل من الطاقة المحررة من احتراق الوقود، أي أن قيمة الطاقة الرابطة الكيميائية EL التي وجدتها في التجربة اقل من القيمة الحقيقية. لأنه هناك ضياع طاقوي ومنه EL > 20925 j/g
نتيجة:
يمثل التحويل الحراري اللازم لاحتراق الوقود (البوتان C4H10)، الطاقة اللازمة لتغيير الحالة الكيميائية، نتيجة التفاعل بين الذرات. حيث تقطع روابط، وتتكون أخرى. يعبر هذا التحويل عن طاقة الرابطة الكيميائية Eℓ .
تطبيق:
نستعمل مسخن يشتغل بغاز البوتان C4H10 لتسخين الماء، حيث ترتفع درجة حرارته من θ1 = 20°C الى θ2 = 80°C ، ويمتص الماء طاقة قدرها 75% من الطاقة الناتجة عن احتراق الغاز.
1 ـ أ ـ أكتب معادلة تفاعل احتراقه ؟
ب ـ أحسب الطاقة الناتجة عن هذا التفاعل ؟
جـ ـ اذا كان حجم الغاز المستهلك خلال 10 دقائق هو V = 60 L
ـ أحسب الطاقة الناتجة عن هذا الحجم ؟
د ـ استنتج كتلة الماء المسخن ؟
هـ ـ أحسب معدل جریان الماء ؟
2 ـ ندخل الماء السابق في مسعر حراري مكافئه المائي µ = 200 g ، بعد مدة نقيس درجة حرارة الماء في المسعر نجدها θ3 = 79,5°C
- أحسب درجة حرارة المسعر الابتدائية θ0 ؟
المعطيات:
ce = 4185 J/kg.°C ، VM = 24 mol/l ، الكتلة الحجمية لماء: ρ = 1kg/L
EC=O = 795 KJ/mol ، EO=O = 494 KJ/mol
، EC-H = 410 KJ/mol ،
EC-C = 348 KJ/mol ، EH-O = 460 KJ/mol
الحل:
1 ـ أ ـ كتابة معادلة تفاعل الاحتراق:
2C4H10(g) + 13O2(g) = 8CO2(g) + 10H2O(g)
ب ـ حساب الطاقة الناتجة عن هذا التفاعل:
Q = 8×2EC=O + 10×2EH-O - 2×10EC-H - 2×3EC-C - 13EO=O
ومنه: Q = 16×795 + 20×460 - 20×410 - 6×348 - 13×494
ومنه: Q = 12720 + 9200 - 8200 - 2088 – 6422
ومنه: Q = 5210 KJ
جـ ـ حساب الطاقة الناتجة عن هذا الحجم:
لدينا:
ولدينا:
2 mol → 5210 KJ
و: 2,5 mol → Q'
ومنه:
د ـ استنتاج كتلة الماء المسخن:
نحسب مقدار الطاقة الممتصة من طرف الماء:
ومنه:
ولدينا: Q" = ce.m(θ2 – θ1) ومنه: m = Q"/ce(θ2 – θ1)
ومنه:
ومنه:
ومنه: m = 19,45 kg
هـ ـ حساب معدل جریان الماء:
لدينا:
و:
وبالتالي:
ومنه:
2 - حساب درجة حرارة المسعر الابتدائية θ0:
لدينا: Qe + Qµ = 0 ومنه : ce.m(θ3 – θ2) + ce.µ(θ3 – θ0) = 0
ومنه: ce.m(θ3 – θ2) = ce.µ(θ0 – θ3)
ومنه:
ومنه:
ومنه: θ0 = 30,88°C
التفسير المجهري
تتغير الروابط الكيميائية، نتيجة التفاعل بين الذرات حيث تقطع روابط، وتتكون روابط أخرى، مما يحدث تغييرا في مخزون الطاقة الكامنة الميكروسكوبية للجملة،
تدعى هذه الطاقة
ـ طاقة الرابطة الكيميائية ـ وتساوي قيمتها قيمة التحويل الحراري الذي يحدث.
اقرأ الطاقة الداخلية. 1/2


تعليقات
إرسال تعليق